Rev Med UAS
Rev Med UAS; Vol. 14 No. 3. Julio-Septiembre 2024
ISSN 2007-8013
Víctor Fernando Muñoz-Estrada1, Edwin Daniel Maldonado-Domínguez2, Wendoline Almeida-Vega2*, Lariza Meza-Machado2.
*Autor de correspondencia:Dra. Wendoline Almeida Vega
Domicilio: Calle Eustaquio Buelna No. 91, Colonia Gabriel Leyva C.P. 80030 Culiacán, Sinaloa
Tel. (668) 256172 Correo: wendoline.av@gmail.com
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v14.n3.009
Texto Completo PDFRecibido 23 de abril 2024, aceptado 20 de junio 2024
RESUMEN
La talidomida es un fármaco con una historia impactante en la medicina y que causó desastres en gran parte de la población, ya que fue administrada a las personas incorrectas, sin embargo, a lo largo del tiempo se ha reposicionado y en la actualidad se utiliza en múltiples patologías dermatológicas, con resultados terapéuticos excelentes debido a sus propiedades antiinflamatorias, antiangiogénicas e inmunomoduladoras. El objetivo de esta revisión es describir la historia, farmacología, mecanismo de acción, indicaciones en Dermatología y efectos adversos de la talidomida. Obteniendo como resultado que la talidomida tiene múltiples indicaciones en enfermedades dermatológicas así como en otras áreas de la salud.
Palabras clave: Talidomida, dermatología, mecanismo de acción.
ABSTRACT
Thalidomide is a drug with a shocking history in medicine and that caused disasters in a large part of the population, since it was administered to the wrong people, however, over time it has been repositioned and is currently used in multiple dermatological pathologies, with excellent therapeutic results due to its anti-inflammatory, antiangiogenic and immunomodulatory properties. The objective of this review is to describe the history, pharmacology, mechanism of action, indications in dermatology and adverse effects of thalidomide.
Keywords: Thalidomide, dermatology, mechanism of action.
Introducción
En 1954, la compañía farmacéutica alemana Grunenthal desarrolló la talidomida como un fármaco antiemético para el embarazo, que no mostró teratogenicidad cuando se probó en roedores y fue utilizado en más de 40 países.1 Sin embargo, a principios de los años 60s se empezó a documentar que cuando las mujeres embarazadas tomaban talidomida los fetos sufrían graves problemas del desarrollo como malformaciones de las extremidades.2 Para entonces, habían nacido entre 5,000 y 6,000 bebés de 46 países con diversas deformidades externas e internas, incluidas focomelia, sordera, parálisis facial y oculomotora, por lo que en 1961 fue retirada del mercado.3
En 1965 se descubrió que la talidomida era eficaz para tratar el eritema nudoso leproso (ENL)4 y con el tiempo también demostró su utilidad en otras patologías dermatológicas y no dermatológicas. La actividad antiinflamatoria e inmunomoduladora de la talidomida se deben principalmente a su capacidad para bloquear la liberación del factor de necrosis tumoral (TNF-α) por parte de los monocitos,5 por lo que desde entonces se ha utilizado para enfermedades que tienen un origen autoinmune o inflamatorio.
En la actualidad, se sabe que la talidomida tiene múltiples acciones en el cuerpo, posee acciones antiangiogénicas, antiinflamatorias e inmunomoduladoras y ahora se usa con éxito para tratar una amplia gama de afecciones clínicas, incluidos algunos cánceres, mieloma múltiple, ENL19 y, además, recientemente sus acciones antiinflamatorias la han convertido en una terapia potencial para tratar el daño pulmonar inducido por la COVID-19.20
Historia
La historia de la talidomida comenzó en 1953 cuando fue sintetizada por Wilhem Kunz, durante la búsqueda de nuevos antibióticos. Su equipo de trabajo no encontró los resultados deseados y fue cedida al laboratorio alemán Grünenthal en 1954, quién desarrolló el fármaco como un sedante no barbitúrico que fue aprobado para su comercialización en Alemania en 1957.6 Grünenthal había realizado experimentos con roedores los cuales, años después, se demostró que tenían menor sensibilidad a los efectos teratogénicos de la talidomida.7 Fue así como se introdujo en el mercado europeo el 1 de Octubre de 1957 para el tratamiento de la ansiedad, el insomnio, las náuseas y los vómitos en mujeres embarazadas, porque no producía adicción y carecía de los efectos adversos de los barbitúricos.8
En 1959 se comercializaba ya en 48 países de Europa y África, así como en Japón, Australia y Canadá, y después en otros países de América del Sur, especialmente en Brasil.9 Sin embargo, a finales de ese año, empezaron a surgir reportes de efectos secundarios tipo polineuritis, con parestesias en piernas y manos tras la ingesta durante meses, con afectación sensorial y motora, motivo por el que los Estados Unidos fue uno de los pocos países que no permitió la venta de este medicamento, bajo la recomendación de Frances Kelsey, investigadora de la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés).10
A finales de los años 50s y principios de los 60s, en Alemania, se observó un aumento de la incidencia de recién nacidos con extremidades acortadas y malformadas, sin sospechar inicialmente la causa.6 Unos meses después, W. Lenz y W.G. McBride tuvieron éxito en la identificación del agente teratógeno y la talidomida fue retirada del mercado en Alemania el 27 de Noviembre de 1961.11
Las alteraciones más evidentes que observaron consistían en el acortamiento o desaparición de los elementos proximales de las extremidades, pero con persistencia de las manos, pies y dedos. A esto se le nombró "focomelia", por su similitud con la foca, el mamífero marino. Se estimó que más de 10,000 niños en el mundo nacieron con malformaciones, aunque la cifra exacta no ha sido determinada.6
En 1965 el médico israelí Jacob Sheskin descubrió fortuitamente un nuevo uso para el medicamento. Utilizando talidomida por sus propiedades sedantes, Sheskin trató a un paciente por insomnio que además tenía eritema nudoso leproso (reacción leprosa tipo II). El paciente no sólo pudo dormir, sino que después de 3 días de terapia sus síntomas desaparecieron y sus lesiones cutáneas sanaron.12 Sheskin amplió su investigación y encontró respuestas similares en cinco pacientes más; siguió un estudio doble ciego y pronto se reconoció que la talidomida era un agente eficaz en el tratamiento del ENL.13 Este hallazgo dio lugar a la investigación sobre otras posibilidades terapéuticas del fármaco y en 1979 se empezó a utilizar para el tratamiento del síndrome Behçet, con buenos resultados.14
Durante la década de 1980 y principios de 1990, se descubrió que la talidomida era un tratamiento eficaz para algunas enfermedades autoinmunes como artritis reumatoide y enfermedad crónica de injerto contra huésped.15,16
En 1998 fue aprobado para el tratamiento del ENL por la FDA en los Estados Unidos.1 Ese mismo año se implementó el Sistema para la Educación y Seguridad en la Prescripción de Talidomida (STEPS), un sistema que exige estrictos requisitos de seguridad para controlar la prescripción, dispensación y uso del medicamento.17 Las investigaciones sobre la talidomida continuaron y en 1999, la talidomida se evidenció como un tratamiento efectivo en el mieloma múltiple.18
Farmacocinética
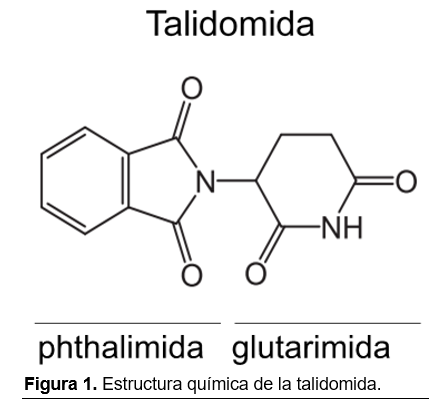
La talidomida (alfa-N-phthalimido-glutarimida o N-[2,6-dioxo-3-piperidil]-ftalimida) es un compuesto racémico neutro derivado del ácido glutámico que está conformada por un anillo de levo-phthalimida y un anillo de dextro-glutarimida (Figura 1). Es una mezcla racémica de dos enantiómeros: la S-Talidomida y la R-Talidomida. Su efecto teratogénico e inmunomodulador se atribuye al enantiómero S mientras que el enantiómero R causa sedación. La edad y el sexo no tienen ningún efecto sobre la farmacocinética de la talidomida y el efecto de los alimentos es mínimo.21 La talidomida se absorbe lentamente después de la administración oral; los niveles máximos en la sangre se alcanzan en 2 a 6 horas y se estima que su biodisponibilidad oscila entre el 67% y el 93%.22,23 El fármaco se distribuye ampliamente por los fluidos y tejidos corporales, con concentraciones más altas en la piel y los riñones. Es liposoluble y atraviesa fácilmente la barrera placentaria.24 Más del 90% de la droga absorbida es excretada en la orina y las heces en las primeras 48 horas.21 Debido a que la talidomida no se metaboliza principalmente por el sistema enzimático del citocromo P450, es poco probable que interactúe con medicamentos metabolizados por esta enzima.25 Sin embargo, la talidomida se hidroliza en numerosos productos excretados por vía renal que se excretan pasivamente, por lo que no se espera que su farmacocinética cambie en pacientes con insuficiencia hepática o renal.21 La talidomida puede aumentar los efectos sedantes del alcohol, la reserpina, los barbitúricos y la clorpromazina. Al ser insoluble en etanol y agua, no se dispone de ninguna preparación parenteral.12

Dosis
Es variable dependiendo de la patología, pero se han demostrado respuestas clínicas desde los 50 hasta 1200 mg. La dosis debe iniciarse con 100 a 200 mg al día, generalmente administrados por la noche como dosis única, debido a sus propiedades sedantes. La dosificación dividida no tiene ningún beneficio adicional con respecto al perfil de toxicidad.26
Mecanismos de acción
La talidomida es conocida por sus propiedades antiinflamatorias, antiangiogénicas e inmunomoduladoras.27 En 1991, se descubrió que la talidomida inhibía la síntesis del factor de necrosis tumoral-α (TNF-α).28 El TNF-α favorece la permeabilidad vascular lo que incrementa el reclutamiento de células inflamatorias, inmunoglobulinas y complemento, además de activar a los linfocitos T y B. Al reducir el TNF- α, la talidomida es un tratamiento eficaz para enfermedades inflamatorias como el ENL y el lupus eritematoso. La talidomida inhibe la producción de TNF-α en monocitos humanos al mejorar la degradación de su ARNm, cambiando la vida media de 30 a 17 minutos en presencia del fármaco.5 La inhibición de la activación de los monocitos favorece la reducción de otras citocinas inflamatorias como interleucinas (IL) 4, IL-5, IL-13 e IL-17.29 También puede modular otras citocinas inflamatorias como IL-1, IL-2, IL-6, IL-8, IL-10, IL-12 e interferón-γ (IFN-γ).30
Efecto antiangiogénico
En 1994 se descubrió el efecto antiangiogénico de la talidomida.31 Utilizando un modelo de conejo, se demostró que la talidomida podría inhibir el factor de crecimiento de fibroblastos y el factor de crecimiento endotelial vascular (VEGF) inducidos durante la angiogénesis. Debido a sus efectos antiangiogénicos, la talidomida puede alterar el desarrollo fetal en mujeres embarazadas, lo que provoca deformidades fetales. Sin embargo, al mismo tiempo este efecto es uno de los mecanismos de su actividad antitumoral.32
Efecto inmunomodulador:
dentro de la respuesta inmune normal, la activación de los linfocitos T por las células presentadoras de antígenos (CPA) requiere de la interacción del complejo mayor de histocompatibilidad tipo II (CMH II) con el receptor de linfocitos T (TCR) y otras moléculas secundarias como B7 (en las CPA) con CD28 (en los linfocitos T).33 Hasta el momento, los efectos inmunomoduladores de la talidomida son poco entendidos. En 1998 se descubrió que la talidomida podía co-estimular a los linfocitos T de forma independiente a la interacción entre las moléculas B7 y CD28.34 También se ha demostrado que la talidomida tiene efecto en las enfermedades mediadas por una respuesta Th1 ya que mantiene un equilibrio entre una respuesta Th1 y Th2.35 Además, en 2010, se descubrió que el cereblon (CRBN) era la principal proteína objetivo de la talidomida.36 CRBN se considera un objetivo directo primario tanto para la actividad anticancerígena como para la teratogenicidad del fármaco. CRBN funciona como un receptor de sustrato único del complejo de ubiquitina ligasa 4 (CRL4) que participa en funciones como la regulación del ciclo celular, la transducción de señales, la regulación transcripcional, la respuesta al daño del ADN, la supresión de tumores y el desarrollo embrionario, lo que produce algunos de sus múltiples efectos beneficiosos y/o teratogenicidad.37 La unión de CRBN con CRL4 reduce los niveles de ciertos factores de crecimiento de fibroblastos que regulan el crecimiento de las extremidades y otros grupos celulares.38
Debido a las diferentes propiedades que tiene la talidomida (sedante no barbitúrico, antiinflamatorio, inhibidor de la síntesis del TNF-α y de la angiogénesis), se utiliza con eficacia terapéutica para diferentes trastornos no dermatológicos como la enfermedad de Chron,39 mieloma múltiple,40 estomatitis aftosa recurrente,41 neoplasias malignas cerebrales primarias,42 síndrome de emaciación relacionado con el VIH,43 sarcoma de Kaposi,44 telangiectasia hemorrágica hereditaria,45 entre otros.
Recientemente, se han desarrollado varios derivados de la talidomida como fármacos inmunomoduladores. Entre ellos, la lenalidomida y la pomalidomida han recibido aprobación en el tratamiento de cáncer como mieloma múltiple, linfoma de células del manto, leucemia mieloide aguda y carcinoma hepatocelular, además de trastornos autoinmunes como el lupus eritematoso sistémico y enfermedad inflamatoria intestinal.46
Indicaciones
En los Estados Unidos, el tratamiento de enfermedades malignas como el mieloma múltiple y los tumores de órganos sólidos representó casi el 90% de las prescripciones de talidomida entre 2001 y 2004.47
En Dermatología, la talidomida se prescribe a menudo como último recurso para enfermedades inflamatorias que no responden a la terapia convencional.47 A continuación se enlistan algunas de las enfermedades cutáneas en las que se ha utilizado:
Eritema nudoso leproso
El ENL forma parte de las reacciones tipo II que ocurre como una complicación inmunológica de la lepra multibacilar y se caracteriza por la formación de nudosidades dolorosas y compromiso sistémico. La reacción se presenta por la formación de complejos antígeno-anticuerpo y altas concentraciones del TNF-α,48 que es inhibida por la talidomida, lo que la hace muy eficaz para el tratamiento de esta complicación.49 Sheskin informó por primera vez la respuesta del ENL a la talidomida en 1965,4 que es la única indicación aprobada por la FDA de Estados Unidos para la talidomida actualmente.49 La talidomida se utilizó para tratar ENL en un grupo de pacientes en 1965, en una dosis de 300 mg al día. Esto llevó a más estudios, incluido un estudio doble ciego, que informó una tasa de respuesta del 92% con la talidomida (en comparación con el 27% en el grupo de placebo).13 Un ensayo doble ciego posterior de la OMS que comparó la talidomida con el ácido acetilsalicílico demostró que la talidomida era casi dos veces más efectiva para provocar la regresión de las lesiones cutáneas, lo que a menudo resultaba en una mejoría clínica dentro de las primeras 24 a 48 horas.50 En estudios posteriores, se observaron respuestas en 70 a 80% de los pacientes tratados con talidomida versus 25% en otros ensayos controlados con placebo, y las dosis de mantenimiento de 25 a 100 mg por día han demostrado ser igualmente eficaces después de controlar los síntomas iniciales.51 Los resultados de un estudio retrospectivo con más de 4000 pacientes con esta afección y tratados con talidomida mostraron que el 99% de las personas respondieron al tratamiento con talidomida en 24 a 48 horas.52
Por lo tanto, la talidomida es el tratamiento de primera línea para el ENL sintomático de moderado a grave,51 con respuesta clínica más rápida, menos recaídas y un periodo de remisión más largo comparado con los esteroides.53
Prúrigo actínico
El prurigo actínico es una fotodermatosis que se caracteriza por lesiones papulonodulares intensamente pruriginosas, que afectan principalmente, pero no exclusivamente, las zonas expuestas al sol. En un estudio de 1973, 34 pacientes con prurigo actínico fueron tratados con 300 mg de talidomida al día; 32 pacientes mostraron mejoría clínica en una media de 50 días. Cuando se retiró la talidomida, los pacientes tuvieron recaída.54 Otros estudios han mostrado resultados similares, con dosis iniciales de 50 a 200 mg y una gran proporción de pacientes que requirieron dosis de mantenimiento de 50 a 100 mg semanales.55
Prúrigo nodular
El prurigo nodular es una enfermedad cutánea inflamatoria crónica y recalcitrante caracterizada por la presencia de nódulos pruriginosos. Se desconoce la patogénesis exacta de la enfermedad, aunque existe una desregulación inmune y neural.56 Esto hace que el tratamiento del prurigo nodular sea difícil y los pacientes suelen ser refractarios a numerosos tratamientos antes de encontrar una solución eficaz. La talidomida a dosis de 50-100 mg/día durante varios meses proporciona un tratamiento alternativo eficaz.57 Se ha demostrado que sus propiedades antipruriginosas y antiinflamatorias alivian el prurito crónico.58 Andersen y colaboradores reportaron una mejoría en 73.8% (31/42) pacientes con prurigo nodular refractario a múltiples terapias, tratados con un promedio de 100 mg de talidomida por 105 semanas.59 Por lo que la talidomida pudiera ser una terapia eficaz para los casos de prúrigo nodular refractarios.
Estomatitis aftosa
El efecto beneficioso de la talidomida en las aftas mucocutáneas y la estomatitis aftosa se ha demostrado en varios estudios.14,60 Un ensayo clínico aleatorizado de 100 mg de talidomida versus placebo por 2 meses en pacientes con estomatitis aftosa grave de >6 meses de evolución, mostró una remisión completa en el 43.8% del grupo de talidomida comparado con el 8.2% del grupo placebo.61 Deng y colaboradores demostraron que una dosis de mantenimiento de 25 mg por 8 semanas puede reducir el número de recaídas en pacientes con estomatitis aftosa recurrente.62 Las úlceras aftosas suelen curarse por sí solas y la talidomida debe reservarse sólo para los casos más graves o recalcitrantes.
Lupus eritematoso discoide
El lupus eritematoso discoide (LED), una forma de lupus cutáneo crónico, se caracteriza por placas que, en ausencia de tratamiento temprano, pueden dejar cicatrices desfigurantes y atrofia cutánea.63 La primera línea de tratamiento para LED incluye fármacos antimaláricos y/o esteroides tópicos. Aunque la mayoría de los pacientes responden a este régimen, hasta el 45% de los casos son refractarios.64 En 1983 se observó por primera vez una rápida mejoría de las lesiones de 2 pacientes con LED utilizando talidomida como tratamiento.65 Desde entonces, más estudios han demostrado su eficacia en LED.66-68 La talidomida podría actuar como un agente antiinflamatorio al inhibir la producción del TNF-α que es escencial para la activación de linfocitos T y B. También puede reducir citocinas presentes en las lesiones de LED, como IL-8 e IL-12, y como resultado, disminuir el reclutamiento de células inmunes en el sitio de lesión. La eficacia de la talidomida es del 80-90% de acuerdo a diversos estudios.69,70 La mejoría clínica se observa en las primeras 2 semanas de tratamiento, con una respuesta completa entre las primeras 4 a 8 semanas.35 Aunque ningún estudio ha establecido una dosis de inducción y mantenimiento para el control de las lesiones, los diferentes estudios han utilizado entre 100 y 400 mg/día.71 La recaída puede ocurrir en un 70% de los casos al disminuir la dosis o suspender el tratamiento, por lo que se puede indicar una dosis de mantenimiento de 50 mg/día o en días alternos para mantener la remisión.72 A pesar de la eficacia de la talidomida en el LED, su uso es limitado porque no se han realizado ensayos clínicos a gran escala y debido a los eventos adversos graves que incluyen teratogenicidad, neuropatía periférica y eventos trombóticos, por lo que no se considera tratamiento de primera línea.35
Síndrome de Behçet
El síndrome de Behçet es una vasculitis sistémica de etiología desconocida. Se caracteriza por lesiones mucocutáneas recurrentes y manifestaciones oculares, neurológicas y gastrointestinales73. Las lesiones orales y genitales del síndrome de Behçet mejoraron después del tratamiento con talidomida (100 mg o 300 mg) versus placebo en un ensayo controlado aleatorio en 96 pacientes, con respuestas completas reportadas en siete de 63 participantes. Por lo general, las lesiones orales sanaron en 3 a 4 semanas, pero las recurrencias fueron comunes después de suspender el tratamiento.74,75 Saylan y Saltik informaron que 400 mg/día de talidomida durante los primeros 5 días, seguidos de 200 mg/día durante los siguientes 15 a 60 días, resolvieron las lesiones orales y genitales en 22 pacientes con enfermedad de Behçet.76 Por lo que la talidomida podría considerarse como opción para terapia de segunda línea.
Eritema multiforme
El eritema multiforme es una reacción inmune-mediada que se caracteriza clínicamente por lesiones en diana que se presentan simétricamente en las extremidades (especialmente en las superficies extensoras) y se diseminen centrípetamente.77 Conejo-Mir y colaboradores reportaron dos casos de eritema multiforme persistente con supresión total de la enfermedad después del uso de talidomida.78 Roux y colaboradores reportaron remisión completa en el 66% (23/35) después de 6 meses de tratamiento continuo,79 por lo que la talidomida podría considerarse una opción como terapia de segunda línea en eritema multiforme recurrente o persistente.
Sarcoidosis cutánea
La talidomida puede utilizarse como fármaco alternativo para casos crónicos de sarcoidosis cutánea resistente a la terapia convencional, ya que inhibe el IFN-γ, el TNF-α, IL-12 e incrementa la IL-2 que contrarresta los efectos del IFN-γ y TNF-α. Sin embargo, su empleo es controvertido, ya que algunos estudios han mostrado una reducción en el tamaño del granuloma y el grosor de las lesiones después del tratamiento,80,81 pero otros, como el estudio de Droitcourt y colaboradores, no reportó mejoría de las lesiones cutáneas después de 3 meses de tratamiento con 100 mg de talidomida.82
Pioderma gangrenoso
El pioderma gangrenoso es un trastorno cutáneo ulceroso, doloroso y no infeccioso que se incluye en el espectro de las dermatosis neutrofílicas.83 Múltiples estudios de casos sugieren que la talidomida puede ser útil, a dosis de 100–400 mg/día, cuando otros tratamientos han fallado o la enfermedad es refractaria, aunque se requiere un tratamiento prolongado para prevenir recaídas.84,85
Xantogranuloma necrobiótico
El tratamiento con talidomida para el xantogranuloma necrobiótico se ha reportado en algunos informes de casos. En el primer caso publicado, las úlceras respondieron parcialmente a 200 mg una vez al día, agregándose al tratamiento etretinato después de 3 meses, sin embargo, presentó recaída a los 6 meses.86 Un segundo caso informó resolución completa con talidomida (200 mg/día) y dexametasona en pulsos concomitante, con respuesta sostenida a los 3 años.87 Se requieren más estudios para determinar la utilidad de la talidomida en el xantogranuloma necrobiótico.
Necrobiosis lipoídica
Un caso de necrobiosis lipoídica que no respondió al tratamiento convencional se trató con talidomida (150 mg/día). Cuatro meses después del inicio del tratamiento, hubo mejoría clínica en todas las lesiones y la talidomida se redujo gradualmente a 50 mg al día, sin nuevas recurrencias después de 2 años de terapia como mantenimiento.88 En otro reporte de caso, Shah utilizó talidomida para tratamiento de necrobiosis lipoidica ulcerosa refractaria en una paciente diabética con buena respuesta después de 12 semanas con 100 mg de talidomida.89 Debido a la poca información en la literatura, se requieren más estudios para confirmar la eficacia de la talidomida en la necrobiosis lipoídica.
Pénfigo paraneoplásico
El pénfigo paraneoplásico es una enfermedad ampollosa autoinmune rara asociada con una neoplasia maligna subyacente. El tratamiento actual de primera línea son los corticosteroides sistémicos después de la extirpación o el control del tumor. Otras opciones terapéuticas incluyen inmunosupresores, plasmaféresis, inmunoféresis, inmunoglobulina intravenosa y productos biológicos como rituximab.90 En un estudio de 14 pacientes con pénfigo paraneoplásico, Wang y colaboradores reportaron que, después del tratamiento del tumor asociado, 7 pacientes (58%) tuvieron una remisión completa de la enfermedad después de la administración de la talidomida (75-100 mg/día) combinado con prednisona oral, por lo que puede ser otra opción efectiva, segura y económica para estos pacientes.91
Sarcoma de Kaposi
En 1996 se reportó el caso de una paciente de 14 años, VIH positiva, con sarcoma de Kaposi que fue tratada con talidomida por úlceras orales y que mejoró de las lesiones cutáneas.92 Debido a que la talidomida inhibe el TNF-α y tiene efectos antiangiogénicos, el fármaco se investigó más a fondo en el tratamiento del sarcoma de Kaposi. En un estudio de fase II, Fife y colaboradores trataron a 17 pacientes VIH positivos con sarcoma de Kaposi cutáneo con talidomida (100 mg cada noche durante 8 semanas) de los cuales 35% (6/17) lograron una respuesta parcial.93 Un estudio posterior, en el que 20 pacientes con sarcoma de Kaposi asociado a SIDA fueron tratados con una dosis inicial de 200 mg/día y una dosis máxima de 1000 mg/día, mostró una respuesta parcial en el 47%, con una dosis media de respuesta de 500 mg/día por una media de 19.9 semanas.94 Por lo tanto, la talidomida podría considerarse otra opción terapéutica en el manejo del sarcoma de Kaposi, aunque las dosis no están establecidas.
Necrólisis epidérmica tóxica
En la patogenia del síndrome de Stevens-Johnson y la necrólisis epidérmica tóxica (NET) está involucrado el TNF-α; es por esto que en 1998 se llevó a cabo un ensayo clínico con talidomida que tuvo que ser suspendido antes de tiempo por exceso de mortalidad en el grupo de talidomida, por lo que su uso no está recomendado en pacientes con NET.95
Liquen plano
Existen informes de casos que describen resultados favorables con la terapia con talidomida en pacientes con liquen plano grave y refractario, especialmente para las formas erosivas. Los regímenes de tratamiento varían de 25 a 300 mg/día durante diferentes duraciones.96,97 También se observó que la talidomida mejoró un caso de liquen plano pilaris recalcitrante.98
Enfermedad injerto contra huésped
La talidomida se ha examinado como agente terapéutico en la enfermedad de injerto contra huésped (EICH) tanto aguda como crónica, y se ha explorado como un posible medicamento profiláctico12. En 1988, un informe de caso describió la talidomida que condujo a la resolución de la EICH aguda después de un alotrasplante de médula ósea.99 Veintitrés pacientes con EICH crónica refractaria y 21 pacientes con EICH crónica de alto riesgo fueron tratados con 200 mg de talidomida cuatro veces al día. Catorce pacientes lograron una respuesta completa y 12 tuvieron una respuesta parcial; la supervivencia global fue del 64%. Se produjo neuropatía en el 9% de los pacientes tratados, y más del 90% presentó sedación como efecto adverso.16
Condiciones esclerosantes: esclerodermia, escleromixedema.
Tras el éxito en el tratamiento de la EICH, se utilizó la terapia con talidomida en 11 pacientes con esclerodermia. Se observó repigmentación de la piel, curación de úlceras digitales, crecimiento del cabello y mejoría de los síntomas de reflujo. En este estudio se utilizó un régimen de dosificación de 50 mg al día, aumentado hasta un máximo de 400 mg al día.100 En cuanto a escleromixedema, un informe de caso de 2004 observó buenos resultados con el uso de 100 mg de talidomida al día, 101 mientras que una serie de casos de ese mismo año describió una leve mejoría utilizando 200 mg de talidomida al día en dosis divididas.102
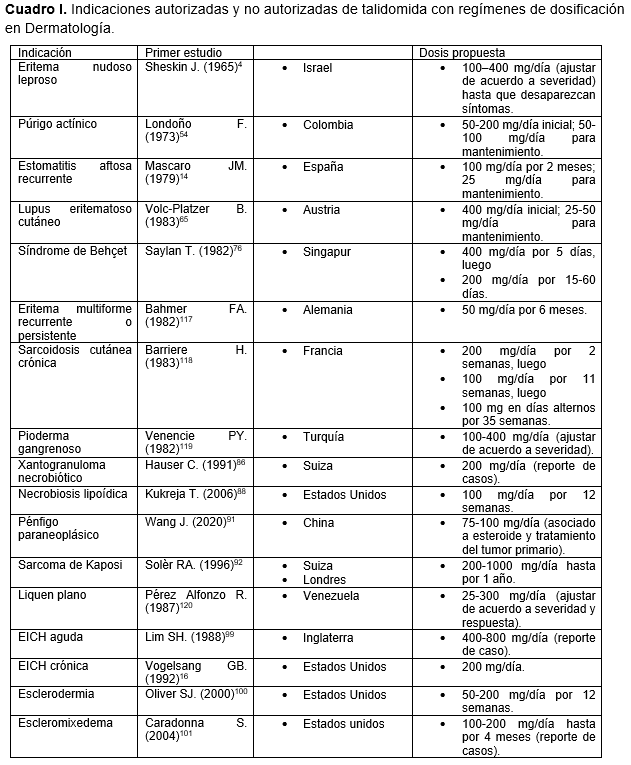
En el cuadro I se muestran algunas indicaciones autorizadas y no autorizadas de talidomida con regímenes de dosificación en Dermatología.103
Efectos adversos
La talidomida no es adictiva y no tiene efectos adversos agudos si se ingieren dosis de hasta 14 g, excepto teratogenicidad en mujeres embarazadas.104 La somnolencia y la fatiga son efectos adversos comunes de la talidomida, y más del 75 % de los pacientes experimentan una sedación leve. El estreñimiento es otro efecto adverso extremadamente común, que puede ocurrir en 80% a 90% de los pacientes y generalmente es leve.105,106 Con dosis más altas de 200 a 1200 mg/día se pueden observar neuropatía periférica, mayor sedación, riesgo de tromboembolismo pulmonar y disnea.107,108 Se sabe desde el lanzamiento original de la talidomida que el uso prolongado puede causar neuropatía periférica en adultos,109 la cual es una afección en la que los nervios se dañan y provocan dolor e hipersensibilidad, generalmente en las extremidades. No está claro cómo el fármaco induce esta afección; sin embargo, se recomienda a los pacientes que dejen de tomar talidomida si comienzan los síntomas.7 La neuropatía periférica puede ocurrir con más de 1 mes de uso de talidomida en dosis superiores a 25 mg al día y aumenta en frecuencia con el uso a largo plazo (6 meses de tratamiento). Los efectos adversos poco comunes incluyen amenorrea, edema, neutropenia, bradicardia, sequedad de boca y piel, prurito, cefalea, hipotensión, aumento del apetito, cambios de humor, disfunción sexual masculina, náuseas, taquicardia y aumento de peso.110,111
Embriopatía por talidomida
La talidomida está clasificada en la categoría X del embarazo porque su uso durante la gestación está asociada con deformidades de las extremidades, huesos, oído externo, ojos, órganos internos y/o parálisis facial.112 El periodo sensible, es decir, el periodo exacto del desarrollo en el que la talidomida produce las malformaciones de las extremidades, está comprendido entre los días 38 a 47 contando desde el primer día de la última regla, y afecta al 50% de los fetos expuestos a talidomida.8 Este periodo sensible coincide con un período de rápido desarrollo embrionario (a partir de 4 semanas) con muchos movimientos celulares, organogénesis y muchas vías de señalización activas. La embriogénesis generalmente dura hasta aproximadamente las 10 a 11 semanas después de la concepción. Por lo tanto, el uso de talidomida para aliviar los síntomas de las náuseas matutinas (que puede ocurrir a partir de la semana 4 en adelante) coincide con los principales eventos del desarrollo embrionario que sustentan la tragedia de la talidomida. Por el contrario, la exposición a la talidomida antes de este periodo puede inducir abortos espontáneos en humanos y ratas.7 Se desconoce el efecto de la talidomida sobre la espermatogénesis. Sin embargo, puede estar presente en el semen, por lo que aconseja el uso de preservativo a los hombres que estén tomando talidomida y puedan embarazar a su pareja.113
La focomelia es la deformidad de las extremidades más llamativa causada por la talidomida, la cual es un acortamiento de las extremidades, donde los elementos distales (mano) permanecen pero los elementos proximales (huesos largos) están reducidos o faltan. El pulgar es la primera estructura afectada, seguido del radio, el húmero y, por último, el cúbito. El miembro inferior también puede presentar deformidades en las extremidades. Sin embargo, las anomalías de las extremidades inferiores se observan con menos frecuencia que las de las extremidades superiores, siendo las deformidades de las extremidades inferiores por sí solas muy raras.114
Los ojos y los oídos también pueden verse afectados. Los defectos del oído suelen ser simétricos y van desde la ausencia total del oído externo o del pabellón auricular (anotia) hasta parte del oído externo que aún queda (microtia).115 La parálisis facial y la asimetría facial también se han asociado con la embriopatía por talidomida y se cree que se deben al debilitamiento de los músculos faciales y al daño del nervio facial. Además, se ha observado una variedad de otros efectos en las estructuras faciales en los sobrevivientes de talidomida, incluido un número y espaciado irregular de los dientes, micrognatia, paladar hendido y labio hendido, y narices pequeñas.114
Todos los órganos internos pueden verse afectados por la exposición a la talidomida en el útero. Los daños comunes observados incluyen malformaciones del corazón, los riñones, los genitales y los intestinos. Se desconoce la incidencia precisa de tales deformidades, ya que dichos defectos no se pueden ver externamente y algunos problemas no siempre se presentan hasta más adelante en la vida.115
En el cuadro II se muestran las recomendaciones para la prescripción de talidomida.49,116

Conclusiones
La talidomida, después de haber iniciado su uso para sintomatología ocasionada por el embarazo, terminó siendo una desgracia ya que fue administrada a las personas incorrectas ocasionando focomelia y otras malformaciones en recién nacidos. Posteriormente la medicina proscribió a la talidomida; la inteligencia médica pudo reposicionar un fármaco con grandes cualidades, sobre todo como inmunomodulador. Hoy día la talidomida es eficaz en varias afecciones dermatológicas refractarias a las terapias convencionales como eritema nudoso leproso, prúrigo actínico, prúrigo nodular, estomatitis aftosa, lupus eritematoso discoide, síndrome de Behçet, eritema multiforme, pioderma gangrenoso, entre otras. Sin embargo, su uso es controvertido en tras patologías como la sarcoidosis cutána donde algunos estudios como Droitciurt y colaboradores, no reportó mejoría después de tres meses de tratamiento. Debido a la historia de la talidomida esta representa uno de los casos más exitosos de reposicionamiento de un fármaco.
Referencias