Rev Med UAS
Rev Med UAS; Vol. 14 No. 3. Julio-Septiembre 2024
ISSN 2007-8013
Cecilia Rico-Fuentes1, Edgar Iván López-Pulido1, Julio César Villegas-Pineda2, Ana Laura Pereira-Suárez2,3, Brisceyda Arce-Bojórquez5, Marisol Montoya-Moreno5, José Ricardo Zataráin López5, José Miguel Moreno-Ortíz4, Adrián Ramírez-de-Arellano2*
*Autor de correspondencia:Adrián Ramírez de Arellano Sánchez
Sierra Mojada No. 950 Puerta 7, Edificio O planta baja, Col. Independencia, C.P. 44340, Guadalajara, Jal.
Tel: (331) 494-71-44 E-mail: adrian.ramirez@academicos.udg.mx
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v14.n3.003
Texto Completo PDFRecibido 23 de abril 2024, aceptado 18 de junio 2024
RESUMEN
El cáncer de próstata (CaP) es la segunda enfermedad más frecuente a nivel mundial según la Organización Mundial de la Salud (OMS). Uno de los mayores desafíos en los métodos de tratamiento es el control de la metástasis; por lo tanto, para com-prender mejor el proceso de señalización, nos centramos en el Receptor Acoplado a Proteína G para Estrógenos (GPER), el cual ha sido relevante en el desarrollo del CaP. Hasta la fecha, pocos informes sugieren que GPER induce vías de señalización; sin embargo, su participación aún no ha sido esclarecida en CaP. Objetivo: Evaluar la activación de vías de señalización activadas por GPER en células de CaP. Los materiales y métodos utilizados fueron líneas celulares humanas PC3 y LNCaP, el cual se realizó una estimulación celular con el agonista G1 y estradiol, posteriormente se realizó la técnica por western blot. Resultados: Se observo la activación de la vía de señalización MAPK mediante GPER en la línea celular PC3. Conclusión: las vías de se-ñalización, como MAPK/ERK muestra tener importancia en línea celular independiente de andrógenos.
Palabras clave: Cáncer de próstata, GPER, vías de señalización, PI3K, MAPK
ABSTRACT
Prostate cancer (PCa) is the second most common disease worldwide according to the World Health Organization (WHO). One of the main challenges in treatment methods is controlling metastasis; therefore, to better understand the signaling process, we focus on the G Protein-Coupled Estrogen Receptor (GPER), which has been significant in the development of PCa. To date, few reports suggest that GPER induces signaling pathways; however, its role in PCa remains unclear. Objective: To evaluate the acti-vation of signaling pathways mediated by GPER in PCa cells. Materials and methods: Human cell lines PC3 and LNCaP were used, with cell stimulation by the agonist G1 and estradiol, followed by western blot analysis. Results: Activation of the MAPK signaling pathway was observed via GPER in the PC3 cell line. Conclusion: Signaling pathways, such as MAPK/ERK, appear to play a significant role in androgen-independent cell lines.
Keywords: Prostate cancer, GPER, signaling pathways, PI3K, MAPK
INTRODUCCIÓN
El cáncer de próstata es el padecimiento más frecuentemente diagnosticado y la quinta causa de mortalidad entre los hombres a nivel mundial.1 Aunque los tumores en etapas tempranas pueden reestablecerse, esto no garantiza un tratamiento efectivo debido a la heterogeneidad de los factores que induce múltiples vías de señalización. Actualmente, los mecanismos moleculares relacionados con las vías de señalización no se comprenden completamente. Además, estos mecanismos podrían mejorar el éxito terapéutico entre los pacientes con CaP. Se sabe que los estrógenos son hormonas críticas que regulan el desarrollo de trastornos tumorales.2 GPER es un receptor activado por estradiol involucrado en la progresión del CaP, dicha proteína ha ganado relevancia últimamente en la carcinogénesis debido a su activación de vías de señalización 3 en los cánceres como colorrectal4 mama5 y de próstata6. Actualmente, existe controversia en su papel en el cáncer; ya que, para algunos autores, GPER es pro-tumoral 7, mientras que para otros es anti-tumoral8, lo que sugiere que el entrecruzamiento entre el microambiente y las vías de señalización determinan el comportamiento de GPER. De hecho, este receptor actúa a través de respuestas estrogénicas no genómicas y regula las vías de la proteína quinasa activada por mitógenos (MAPK) 9 y el fosfatidilinositol 3-quinasa (PI3K).10 La vía MAPK se considera ser un regulador clave de la distribución del ciclo celular, además de estar relacionada con el crecimiento y la migración, como consecuencia de la supervivencia y la sensibilidad a los fármacos.11 Se sabe que, bajo hipoxia, p38/MAPK es responsable de la reorganización del citoesqueleto, lo que promueve la migración e invasión en distintos tipos celulares.12 Por otro lado, PI3K se encarga de regular la actividad y la expresión de proteínas involucradas de la progresión del ciclo celular, como ciclina D y las proteínas inhibidoras de la quinasa dependientes de ciclina p21 y p27.13
Se ha observado en el CaP resistente a la castración (CPRC), la activación de MAPK a través de mTOR está asociada con el eje de señalización mediado por receptores de estrógenos.14 Un estudio menciona que el efecto estimulante de G-1 activa la transición epitelio-mesénquima (EMT) mediante la vía dependiente de JNK/ERK1/2 MAPK en células colorrectales.11 Por otra parte, en PI3K el PTEN se considera un regulador negativo, la pérdida de dicha proteína activa AKT el cual provoca un evento crítico en la progresión de CaP.15 Lo que aún queda por descubrir es si GPER actúa a través de la activación de MAPK y PI3K en células de CaP.
Actualmente, no hay evidencia de un mecanismo molecular involucrado en la regulación de vías de señalización mediado por GPER en la enfermedad de CaP. Por lo tanto, este trabajo tiene como objetivo evaluar el comportamiento de GPER en la activación de vías de señalización MAPK y PI3K en células PC3 y LNCaP de CaP.
Materiales y métodos
Cultivo celular
Las líneas celulares humanas de CaP PC3 y LNCaP fueron obtenidas de la American Type Culture Collection (ATCC, Manassas, VA, EE. UU.). Estas líneas celulares fueron subcultivadas cada tres a cuatro días hasta alcanzar un 80% de confluencia. Se cultivaron en medio Dulbecco's Modified Eagle's Medium para la línea celular PC3 (DMEM, Sigma Aldrich, cat. No D5796) y en Roswell Park Memorial Institute Medium (RPMI 1640, Sigma Aldrich, cat. No. A5955) para la línea celular LNCaP, suplementado con 10% de suero fetal bovino, FBS (Sigma Aldrich, cat. No A5955) y 1% de solución antimicótica antibiótica (Sigma Aldrich, cat. No. F4135). Las células se mantuvieron en una atmósfera de CO2 al 5% y 37°C.
Anticuerpos
Los anticuerpos monoclonales de ratón contra p-AKT1/2/3 (cat. No. SC-81433), AKT1/2/3 (cat. No. SC-81434), p-ERK1/2 (cat. No. SC-136521), ERK1/2 (cat. No. SC-514302) y β-actina (cat. No. SC-47778) fueron adquiridos de Santa Cruz Biotechnology. Un anticuerpo secundario dirigido contra IgG de cabra anti-ratón (HRP) (cat. No. ab6789) fue adquirido de Abcam.
Estímulo celular y extracción de proteína
Las células PC3 y LNCaP fueron estimuladas usando G1 (1 μg/mL) y 17β-estradiol (0.01 µg/mL) durante 30 minutos y se realizaron tres réplicas. Las líneas celulares fueron lisadas con tampón RIPA (50nM Tris-HCl; 100mM NaCl; 1mM EDTA; pH 7.4), complementado con un cóctel de inhibidores de proteasa en una proporción de 1:100 (Sigma Aldrich, MS-SAFE-5VL). La cuantificación de proteínas se realizó mediante la técnica de Bradford a 540nm.
Western Blot
Junto con PageRuler Plus (Thermofisher cat. No. 266619), las proteínas fueron compactadas y separadas por electroforesis durante 75 minutos a 85 y 110 voltios, respectivamente. Luego se transfirieron a membranas de PVDF y se bloquearon durante la noche en un 5% de BLOT-Quickblocker™ Reagent (cat. No. WB57-175GM). Las membranas se incubaron con anticuerpos primarios diluidos en una solución bloqueadora al 1% a 4°C durante la noche. Después de ser lavadas con PBS con Tween, las membranas fueron incubadas con anticuerpos secundarios conjugados con HRP. Las proteínas se visualizaron en un fotodocumentador MicroChemi, versión 6.0, y se cuantificaron utilizando GelQuant versión 1.8.2.
Análisis estadísticos
Los experimentos fueron realizados por triplicado y los datos obtenidos fueron analizados utilizando ANOVA de una vía utilizando el software estadístico Prism 7 considerándose como estadísticamente significativo un valor p<0.05.
Resultados
E2 activa la vía de señalización PI3K en la línea celular PC3
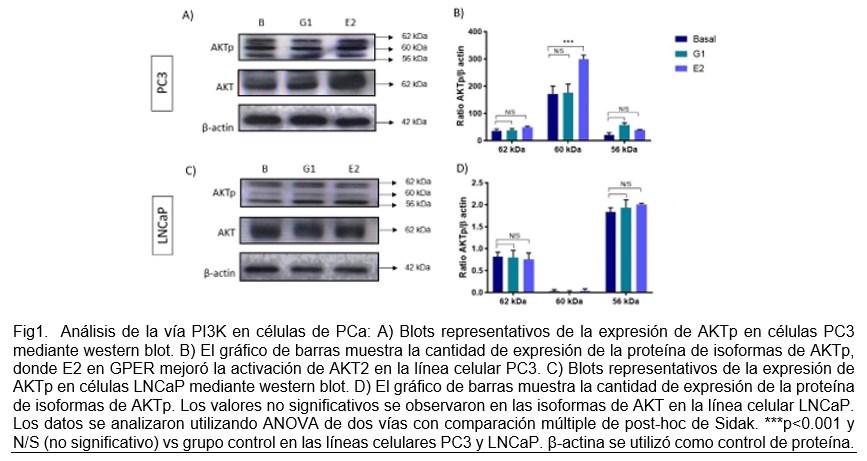
Se realizó la identificación de proteínas asociadas a AKTp involucradas en las vías de señalización PI3K en células PC3 y LNCaP estimuladas con G1 y E2. En la Fig. 1 identificamos la expresión de AKTp y AKT para la línea celular PC3 y LNCaP con los estímulos G1 y E2.
GPER activa la vía de señalización MAPK en la línea celular PC3
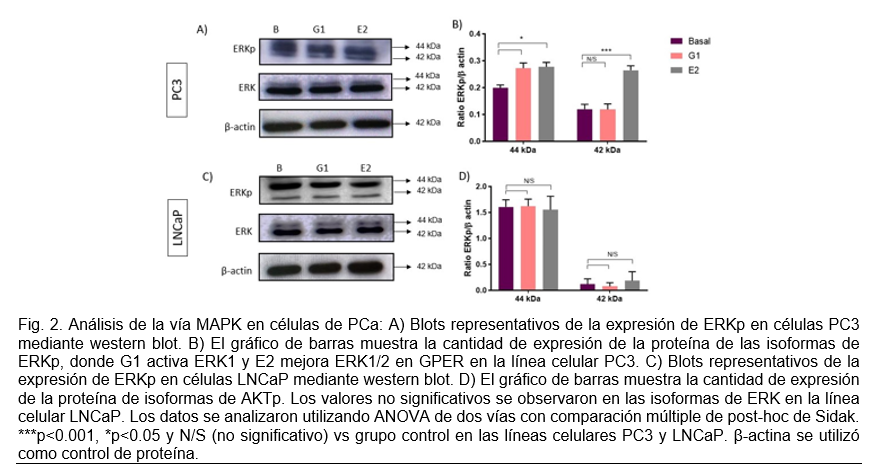
Se realizó la identificación de proteínas asociadas a ERKp involucradas en las vías de señalización MAPKs en células PC3 y LNCaP estimuladas con G1 y E2. En la Fig. 2 la expresión de ERKp y ERK con los estímulos G1 y E2, se observa un aumento con el estímulo G1 y E2 con una diferencia significativa de p<0.05 para la isoforma 44 kDa, por otro lado, para la isoforma 42 kDa presenciamos un aumento en E2 con una diferencia significativa de p<0.001 respecto al basal.

Discusión
La enfermedad de CaP tiene la quinta tasa de mortalidad más alta entre los cánceres que afectan a la población masculina en todo el mundo.1Nuestros resultados muestran la activación de ERK1/MAPKs a través de GPER en PC3, la cual se caracteriza por ser una línea celular independiente de andrógenos. Dicho comportamiento coincide con el estudio de Prossnitz y col.16 además se menciona que la activación de GPER es mediada por E2 el cual estimula la movilización de calcio intracelular y la activación de PI3K.17 Aunque este último, no se vio reflejado en nuestros resultados. Actualmente, existe información limitada sobre la significancia biológica de GPER asociada con la activación de vías de señalización en la enfermedad de CaP. Con base a los resultados, sugerimos que GPER activa MAPK en la línea celular PC3.
La activación de PI3K y MAPK a través de GPER en células PC3 puede contribuir a la resistencia a la apoptosis y al aumento de la proliferación celular, lo que es consistente con los hallazgos previos que muestran que la expresión de GPER se asocia con un peor pronóstico en pacientes con cáncer de próstata. Además, la activación de estas vías de señalización puede también contribuir a la invasión y metástasis, ya que la vía PI3K/AKT regula la expresión de genes involucrados en la invasión y la vía MAPK/ERK regula la expresión de genes involucrados en la migración celular.18
Nuestros resultados sugieren que la inhibición de GPER y/o la vía PI3K/AKT y MAPK/ERK podría ser una estrategia terapéutica efectiva para tratar el cáncer de próstata avanzado. De hecho, varios inhibidores de PI3K y MAPK están siendo evaluados actualmente en ensayos clínicos para el tratamiento del cáncer de próstata 19. Sin embargo, es importante destacar que la expresión de GPER y la activación de estas vías de señalización pueden variar entre diferentes subtipos de CaP, por lo que es necesario realizar más investigaciones para determinar la efectividad de estos inhibidores en diferentes contextos clínicos.
Conclusiones
A pesar del avance en la detección temprana del cáncer de próstata, los tratamientos para las formas metastásicas de la enfermedad siguen siendo escasos, lo que plantea un reto importante en la comprensión de vías de señalización en CaP. La exploración de GPER en vías de señalización, como MAPK/ERK muestra tener importancia en línea celular independiente de andrógenos. Sin embargo, se requiere más investigación para esclarecer el papel exacto de GPER y su entrecruzamiento en vías de señalización para asimismo proponer un objetivo terapéutico en CaP.
Conflicto de interés
Los autores no declaran conflicto de interés
Agradecimientos
CONAHCYT, Ciencia Básica y de Frontera 2023-2024 (CBF2023-2024-2702)
Referencias