Rev Med UAS
Rev Med UAS; Vol. 14: No. 2. Abril-Junio 2024
ISSN 2007-8013
Ángel R. Rábago-Monzón1,3, Alexis M. Rodríguez-Rosas1, Diana L. Baldenebro-Félix3, Josué Camberos-Barraza1,3, Alma M. Guadrón-Llanos1, Víctor M. Ruíz-Ruelas1, Alberto K. De la Herrán-Arita1, Javier A. Magaña-Gómez2, Carla E. Angulo-Rojo1*
*Autor de correspondencia:Carla E. Angulo-Rojo, Facultad de Medicina, Universidad Autónoma de Sinaloa. Culiacán, Sinaloa, México. Email: carla.angulo@uas.edu.mx ORCID: 0000-0002-5097-2444
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v14.n2.008
Texto Completo PDFRecibido 02 de octubre 2023, aceptado 27 de febrero 2023
RESUMEN
En los últimos años, las investigaciones en el campo de la neurociencia han revelado que enfermedades neurodegenerativas presentan una estrecha relación con el microbioma intestinal. Estudios clínicos y preclínicos, sugieren que el microbioma intestinal desempeña un papel crucial en el cerebro y revelan que un desequilibrio en su composición puede estar vinculado a enfermedades neurodegenerativas, cuyos mecanismos subyacentes aún requieren mayor estudio. Esta revisión tiene como objetivo destacar la relación entre el microbioma intestinal y las enfermedades neurodegenerativas, así como profundizar en la comprensión de su función y mecanismos relevantes. Además, se discuten las aplicaciones actuales y las perspectivas futuras de terapias relacionadas con el microbioma, las cuales, podrían abrir nuevas vías en la investigación de enfermedades neurodegenerativas.
Palabras claves: microbioma, microbiota, enfermedad neurodegenerativa, neurociencias.
ABSTRACT
Recent neuroscience research has shown a strong connection between neurodegenerative illnesses and the gut flora. Research indicates that the gut microbiome significantly influences the brain and shows that an abnormal composition may be associated with neurodegenerative illnesses, which necessitate more investigation into their root causes. This review seeks to emphasize the connection between the gut microbiota and neurodegenerative illnesses, while also aiming to enhance comprehension of their roles and associated processes. The article explores the present uses and potential advancements of microbiome-based treatments, which may lead to new avenues in studying neurodegenerative disorders.
Keywords: Microbiome, microbiota, neurodegenerative disease, neurosciences.
Introducción
La creciente investigación en el campo de la neurociencia ha revelado que las enfermedades neurodegenerativas mantienen una relación con el microbioma intestinal, la cual influye en una amplia gama de patologías, incluida la enfermedad de Alzheimer (EA), enfermedad de Parkinson (EP) y Esclerosis Lateral Amiotrófica (ELA). Actualmente, se ha propuesto que algunos pacientes que presentan un microbioma intestinal desequilibrado (disbiosis), se encuentra asociado a diversas afectaciones en el sistema nervioso central (SNC), lo que sugiere un vínculo significativo entre la salud intestinal y el cerebro 1. Por otro lado, el envejecimiento también está relacionado con los cambios del microbioma y la pérdida de diversidad, estas alteraciones pueden contribuir a la inflamación crónica, característica de la enfermedad de Alzheimer y otras patologías neurodegenerativas, lo que resalta el papel potencial del microbioma en la patogénesis de estas enfermedades 2,3.
Otras implicaciones que tiene el microbioma intestinal es su composición con diferentes marcadores proinflamatorios, como los niveles de MCP-1 (Monocyte Chemoattractant Protein-1), denominado como un indicador de inflamación sistémica. Este vínculo sugiere que el microbioma puede participar ampliamente en la etiopatogenia de las enfermedades neurodegenerativas a nivel mundial, además del desarrollo de enfermedades metabólicas, y el progreso del estado de inflamación4. También, se ha identificado una conexión entre la disbiosis intestinal y la señalización neuro inflamatoria, sugiriendo que la disbiosis podría ser un marcador de enfermedades neurodegenerativas y ofreciendo posibles alternativas terapéuticas para reducir la neuroinflamación 5.
Recientes estudios han demostrado interesantes avances en el uso de probióticos, prebióticos y simbióticos para abordar estas enfermedades, estableciendo nuevas estrategias de diagnóstico oportuno y desarrollo de medicamentos terapéuticos2. De manera específica, se ha encontrado una asociación entre el microbioma intestinal y algunas enfermedades neurodegenerativas, con una disbiosis notable entre estos pacientes en comparación con individuos sanos 3,6.
Esta revisión, resume la evidencia existente sobre el vínculo del microbioma intestinal con las enfermedades neurodegenerativas, discutiendo diferentes mecanismos subyacentes, implicaciones clínicas y microorganismos relacionados al desarrollo de la enfermedad. Particularmente, se hará énfasis en la microbiota, conjunto de bacterias colonizadoras del intestino, cuya disbiosis es de las que más evidencia se ha generado.
Relación entre el microbioma y las enfermedades neurodegenerativas
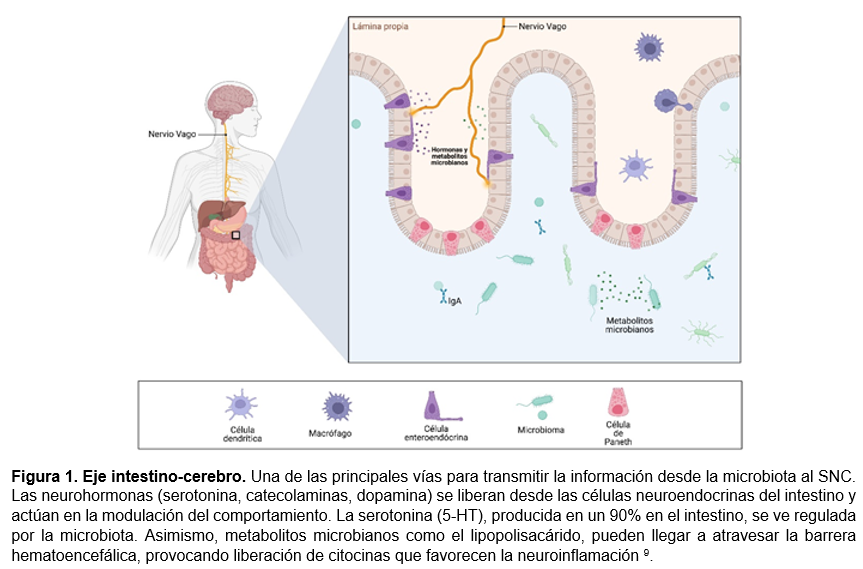
Las enfermedades neurodegenerativas se caracterizan por la gradual disminución de la función neuronal, lo que conduce eventualmente a un deterioro en la función motora y/o cognitiva. En la actualidad, la prevalencia de estas enfermedades está en aumento de manera significativa. A pesar de que la susceptibilidad genética participa constantemente como factor de riesgo, los factores ambientales a lo largo de la vida también tienen una gran influencia en la aparición, progresión y severidad de estas condiciones 7. Existen una gran cantidad de factores asociados a la densidad y diversidad de nuestros microbiomas que se encuentran influenciados por factores genéticos, aspectos nutriciones, localización geográfica, el sistema inmunológico, el historial clínico y la composición de la epigenética. Aunque los mecanismos subyacentes aún no se comprenden completamente, la hipótesis de que el microbioma intestinal afecta a estas enfermedades a través del eje intestino-cerebro está recibiendo cada vez más atención por la comunidad científica (Figura 1) 8.

Además, es importante sugerir que la composición de la microbiota intestinal no solo participa en el diagnóstico oportuno de enfermedades neurodegenerativas y el desarrollo neurológico, sino también, influye en el microbioma intestinal denominado “microbioma-intestino-cerebro”, como posibles biomarcadores terapéuticos para el tratamiento de enfermedades clasificadas como intratables9. Aunque existan limitaciones y cuestionamientos sobre la teoría del microbioma cerebral, la evidencia actual menciona que existe un microbioma en el sistema nervioso central, el cual han detectado bacterias, virus, hongos y arqueas en los cerebros de pacientes con enfermedades neurodegenerativas10.
Microbioma y enfermedad de Alzheimer
Las principales características patológicas de la EA incluyen placas seniles compuestas por péptidos beta amiloide, los ovillos neurofibrilares formados a partir de la acumulación de la proteína tau hiperfosforilada y neuroinflamación. Estas características provocan la pérdida progresiva de la memoria y el deterioro cognitivo12. Diversos estudios moleculares han demostrado que la familia Let-7c aumenta el desarrollo de la EA y juega un papel de activador de receptor similar a toll 7 (TLR7) en las células inmunes, y en las neuronas. Además, se ha investigado que miR-155 participa en los procesos de activación de la inflamación 11.
El microbioma intestinal abarca una amplia diversidad de bacterias, arqueas, protozoos, virus y hongos en el tracto gastrointestinal, esta diversidad ha demostrado tener potencial regulador sobre la neuroinflamación. Dicha regulación puede ocurrir a través de diferentes mecanismos (Figura 2) 13. Estudios demuestran que la manipulación del microbioma intestinal mediante tratamientos con probióticos podría beneficiar a modelos in vivo de EA, como la disminución de placas de beta-amiloide e inflamación cerebral, y mejoras en la memoria 14.
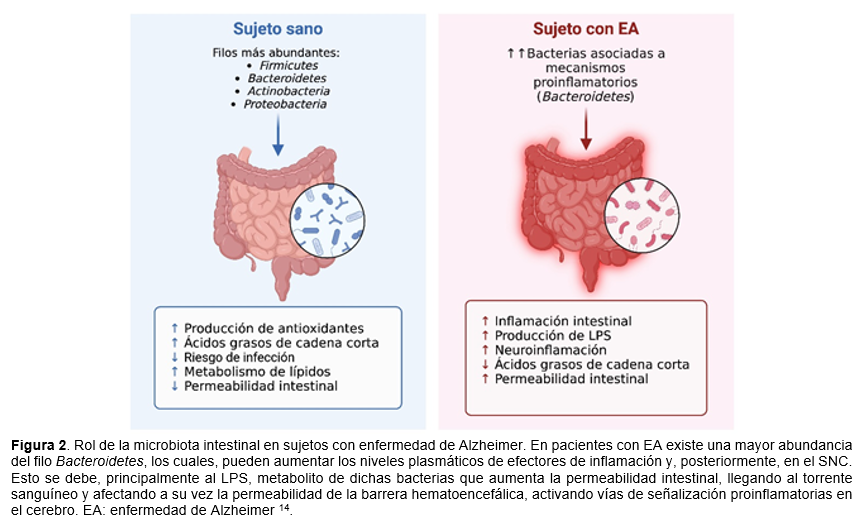
Otras investigaciones han demostrado que la familia de Firmucutes y Clostridiaceae se encuentran asociadas a la disminución de la abundancia en pacientes diagnosticados con EA, influyendo en los efectos antinflamatorios y protectores respecto a la disminución de placas β-amiloide (Figura 2) 14.
Las investigaciones sugieren una relación intrigante entre el microbioma intestinal y la EA. Además, se ha encontrado que las características patológicas y la progresión de la enfermedad pueden estar influenciadas por el microbioma intestinal. También, se ha documentado que diversos agentes infecciosos como Toxoplasma gondii, Chlamydophila pneumonie, virus del herpes simple 1, hepatitis C y citomegalovirus se encuentran asociado al desarrollo de la enfermedad 13.
Igualmente, se ha identificado que el estrés crónico puede contribuir al Alzheimer, con el microbioma intestinal como mediador entre el estrés y la neurodegeneración a través de su influencia en la comunicación entre el intestino y el cerebro, la producción de neurotransmisores, metabolitos, la regulación del sistema inmunitario y la inflamación15. Además, se han encontrado correlaciones genéticas entre ciertos géneros del microbioma y la EA, sugiriendo factores de riesgo y protectores 16,17.
Por otro lado, estudios recientes indican que la composición del microbioma intestinal podría servir como un indicador de la EA en su fase preclínica, correlacionándose con marcadores patológicos, pero no con biomarcadores de neurodegeneración18. Por ejemplo, un análisis meta-analítico de estudios del microbioma reveló una disminución en la riqueza y abundancia de especies en el microbioma intestinal de individuos con EA. Además, se observaron variaciones en la abundancia de ciertos filos y géneros, sugiriendo una relación entre la composición del microbioma y la enfermedad 19. Se descubrió que el microbioma intestinal de un modelo de rata con EA exhibe cambios relacionados con la edad, mostrando una disminución en la diversidad microbiana y cambios en la estructura y composición de la comunidad 20.
En conjunto, estos hallazgos subrayan la importancia del microbioma intestinal en la patogénesis de la EA. La disbiosis, la inflamación y la alteración del eje intestino-cerebro sugieren que el microbioma puede ser un canal para la intervención terapéutica. La restauración de un microbioma intestinal saludable y el uso de terapias dirigidas al microbioma se están investigando como posibles tratamientos para la enfermedad de Alzheimer 21.
Microbioma y enfermedad de Parkinson
La enfermedad de Parkinson es una enfermedad neurodegenerativa crónica en la que se observa una acumulación de proteína alfa-sinucleína mal plegada en las neuronas dopaminérgicas de la sustancia negra y otros circuitos cerebrales. Esto conduce al desarrollo de síntomas motores como bradicinesia, temblores, rigidez y marcha anormal, así como síntomas no motores como problemas gastrointestinales, complicaciones urogenitales, disfunción del olfato y deterioro cognitivo 22.
A pesar de los avances en la investigación, aún no se comprenden completamente las vías y mecanismos exactos responsables del inicio y la progresión de esta enfermedad. Sin embargo, recientes trabajos han demostrado que existe una relación significativa entre alteraciones en el microbioma intestinal y la EP. Estudios han revelado enriquecimiento y depleción de ciertos géneros bacterianos en pacientes con EP, lo que podría contribuir a un estado proinflamatorio y diversos síntomas gastrointestinales recurrentes 22.
Un enfoque clave en la investigación de la EP ha sido el papel del genotipo del hospedador en la composición del microbioma intestinal. Se ha descubierto que la variación genética en el locus de la alfa-sinucleína influye en la sobreabundancia de patógenos oportunistas en el intestino de pacientes con EP, sugiriendo que existe una interacción entre los factores genéticos y el microbioma intestinal en la patogénesis de la enfermedad [23]. Dicha investigación también ha mostrado cambios en la composición del microbioma en individuos con EP, incluyendo diferencias en la abundancia relativa de bacterias de los géneros Lactobacillus y Akkermansia 24.
En cuanto a los marcadores de riesgo y prodromales de la EP, el microbiota intestinal se ha asociado con factores como la inactividad física, el estreñimiento y posibles trastornos del comportamiento del sueño REM, aunque aún requiere mayor investigación para entender completamente este impacto 25.
La disbiosis en el microbioma intestinal de pacientes con EP se caracteriza por una sobreabundancia de patógenos y una alteración en el equilibrio de factores inflamatorios y neuroprotectores, lo que podría ser clave en la patología de la enfermedad, análisis taxonómicos han encontrado que la disminución de la abundancia de Blautia, Prevotella y Faecalibacterium se encuentran relacionados con el desarrollo de la enfermedad 26,27.
Por último, la interacción entre los pesticidas, probióticos, prebióticos y antibióticos participan en la interacción del eje microbioma-intestino-cerebro se está estudiando como un factor en la patogénesis de la EP, con una influencia bidireccional 28,29. En resumen, estos hallazgos resaltan la complejidad de la relación entre el microbioma intestinal y la enfermedad de Parkinson, sugiriendo que las alteraciones en el microbiota intestinal podrían jugar un papel clave en la patogénesis de la enfermedad y ofreciendo nuevas ventanas para el tratamiento y la prevención.
Relación del microbioma con la Esclerosis Lateral Amiotrófica
La esclerosis lateral amiotrófica es una enfermedad neurodegenerativa progresiva y mortal que afecta el sistema nervioso, donde las células nerviosas motoras en el cerebro y la médula espinal mueren gradualmente. La característica principal de esta enfermedad es la pérdida rápida del control muscular, lo que provoca la parálisis total de los músculos voluntarios en todo el cuerpo 30.
La investigación emergente sobre la relación entre el microbioma y la ELA ha revelado que las conexiones significativas podrían influir en la patogénesis de la enfermedad y ofrecer nuevas perspectivas para el tratamiento. Además, se ha observado que las interacciones entre las plaquetas y el microbioma intestinal pueden estar involucradas en los procesos fisiopatológicos asociados con la disbiosis intestinal y la ELA, sugiriendo un vínculo entre el genotipo del huésped y la sobreabundancia de patógenos oportunistas en el intestino, lo que podría contribuir a la patología de la ELA 31.
El microbioma intestinal de los pacientes con ELA difiere significativamente del de los individuos sanos, con cambios correlacionados con variaciones en metabolitos plasmáticos, principalmente lípidos, lo que propone la posibilidad de identificar biomarcadores para la ELA 32.
Se sugiere que las alteraciones en la vía melatonérgica mitocondrial y los factores sistémicos, como la activación de astrocitos, la disbiosis intestinal y la disfunción muscular/junción neuromuscular, podrían estar implicados en la patogénesis de la ELA. Diversos géneros de la familia Bacteroidetes mostraron asociación en el desarrollo de ELA, así como alteraciones en la abundancia de Lachnospiraceae, Firmicutes, Clastridia y Oscillibacter. Diversos microorganismos significativamente mayores se presentaron en pacientes con ELA como Sulfuricurvum kujiense, Cyanothece sp. y Haladaptatus paucihalophilus, sin embargo, la familia de Enterococcus se ha observado disminuido 33.
Los análisis de muestras fecales de pacientes con ELA han revelado cambios significativos en la estructura y función microbiana, indicando que la composición alterada del microbioma intestinal y los productos metabólicos podrían proporcionar información sobre la patogénesis de la ELA y ser objetivos potenciales para intervenciones terapéuticas 34.
Por último, se ha demostrado que la microbiota puede tener un papel protector en modelos de Esclerosis Lateral Amiotrófica (ELA), como el SOD1, al limitar la actividad de la microglía neurodegenerativa. La microbiota puede reducir la neuroinflamación y proteger las neuronas motoras, lo que sugiere que la manipulación del microbioma intestinal podría ser una estrategia terapéutica potencial para tratar la ELA 35. En resumen, estos hallazgos destacan la importancia de explorar más a fondo la compleja relación entre el microbioma y la ELA, sugiriendo un papel potencial del microbioma en la patogénesis y el tratamiento de la enfermedad demostrando que los filos más representativos para el desarrollo de ELA han sido Bacteroidetes y Firmicutes.
Microbioma y envejecimiento
El microbioma intestinal juega un papel crucial en la fragilidad y el declive cognitivo de la vejez. Se ha observado que una biodiversidad reducida del microbioma y cambios específicos en la abundancia bacteriana están asociados con estas condiciones. Las intervenciones dietéticas y el entrenamiento físico pueden mejorar la diversidad del microbiota intestinal y la síntesis de ácidos grasos de cadena corta, ofreciendo protección potencial contra el deterioro cognitivo 36.
Además, algunas dietas con un alto contenido antioxidante (polifenoles), han demostrado influir positivamente en el envejecimiento saludable. Estos efectos incluyen la prolongación de la vida útil, mejoras en el reconocimiento espacial y cambios beneficiosos en la composición del microbioma intestinal 37,38.
Se ha encontrado una mayor abundancia de Akkermansia muciniphila en el microbioma intestinal de individuos que envejecen de manera saludable, sugiriendo un vínculo entre el microbioma intestinal y la longevidad 34. La disbiosis intestinal se ha asociado con un envejecimiento acelerado y procesos inflamatorios, resaltando la importancia de mantener un equilibrio saludable en el microbioma 39.
Los cambios en la composición, diversidad y funciones del microbioma intestinal se han relacionado con el envejecimiento normal y diversas enfermedades relacionadas con la edad. Esto sugiere que las intervenciones dirigidas al microbioma, como el uso de probióticos, prebióticos y el trasplante de microbiota fecal, podrían ofrecer nuevos enfoques terapéuticos para promover un envejecimiento saludable y mitigar enfermedades asociadas con la edad avanzada 40.
Estudios del microbioma en personas mayores promueven que la longevidad se encuentra asociada al equilibrio entre especies bacterianas inflamatorias y antiinflamatorias. Se han identificado que el aumento en familias de bacterias como Escherichia/Shigella y Protobacteria se encontraban en abundancia en grupos de alta longevidad, y disminuida para la familia de Faecalibacterium 40
Conclusión
El microbioma intestinal desempeña un papel importante en el desarrollo de enfermedades neurodegenerativas. Los productos metabólicos generados por los microorganismos del intestino actúan como mensajeros químicos que influyen en la interacción entre el microbioma intestinal y el huésped. Se ha descrito que algunos de estos metabolitos afectan el curso de las enfermedades neurodegenerativas, pero aún hay mucho por explorar sobre las funciones de dichos metabolitos. El propósito de esta revisión fue resumir la evidencia existente que vincula el microbioma intestinal con las enfermedades neurodegenerativas, para orientar a los investigadores interesados en descubrir nuevas posibilidades en este campo poco explorado.
Referencias