Rev Med UAS
Vol. 14: No. 1. Enero-Marzo 2024
ISSN 2007-8013
Ricardo Martínez-Zavala1, Laura G. Hernández-Aragón1, José Everardo Avelino-Cruz2, Fabián Galindo-Ramírez1*
*Autor de correspondencia: Fabián Galindo-Ramírez.
Laboratorio de Cáncer y Comunicación Intercelular, Instituto de Fisiología, Benemérita Universidad Autónoma de Puebla.
14 Sur, 6301, Colonia San Manuel, Ciudad Universitaria Puebla. Puebla, México. C.P. 72570.
Email: fabgalindoram@gmail.com
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v14.n1.010
Texto Completo PDFRecibido 25 de abril 2023, aceptado 07 de diciembre 2023
RESUMEN
Las acciones de los receptores purinérgicos en las células dependen del subtipo de receptor, el tipo celular y de su condición (sana o tumoral). El objetivo de esta revisión es identificar y analizar las rutas metabólicas dependientes de la activación purinérgica asociadas a la progresión del cáncer. En diferentes tipos de cáncer, se ha observado que el ATP está incrementado en el microambiente tumoral y participa en el mantenimiento, proliferación, migración y supervivencia de las células tumorales, a través de los receptores purinérgicos P2. Además, el ATP puede ser degradado a adenosina, la cual, se ha relacionado con la supervivencia y proliferación mediante la activación de receptores P1 en células cancerígenas. Se ha propuesto que la reducción de las concentraciones extracelulas de ATP, adenosina y la activación de receptores purigérgicos sería de gran relevancia en la aplicación de diferentes tratamientos antitumorales.
Palabras clave: ATP, adenosina, nucleotidasas, receptores purinérgicos, cáncer.
ABSTRACT
The actions of Purinergic receptors on the cells depend on receptor subtype, cell types, and health conditions (normal or tumoral cells). This review aims to identify and analyze metabolic pathways depending on purinergic receptors associated with cancer cell progression. In different kinds of cancer, ATP was seen to increase in the tumor microenvironment, and participates in the maintenance, proliferation, migration, and survival, through purinergic receptors P2. In addition, ATP can be degraded to adenosine, which has also been linked to survival and proliferation through the activation of P1 receptors in cancer cells. It has been proposed that reducing the concentration of extracellular ATP, adenosine, and the activation of purinergic receptors would be of great relevance in the application of different antitumor treatments.
Keywords: ATP, adenosine, nucleotidases, purinergic receptors, cancer.
INTRODUCCIÓN
La adenosina 5’ trifosfato (ATP) es un nucleótido cíclico que cumple con múltiples funciones, y no solo es la responsable de la transferencia de energía. La idea de que el ATP se pudiese comportar como un transmisor químico nació en 1929. Drury y colaboradores,1 demostraron potentes acciones extracelulares de ATP y de adenosina en el corazón y en los vasos sanguíneos;2 pero fue hasta 1972 que fue propuesto como un neurotransmisor.3 El ATP no fue la única molécula descrita como un componente importante en la transmisión de estímulos, sino que también, en 1927 se descubrió la presencia de un compuesto de adenina capaz de ralentizar el ritmo y la frecuencia cardiaca,1 este último se trataba de la adenosina. En un principio, se propuso a la adenosina como una hormona o como un segundo mensajero; sin embargo, una vez conocido el mecanismo por el cual se genera en los tejidos, particularmente durante condiciones de estrés, se consideró como un nuevo tipo de regulador celular, y se acuñó con el término de “metabolito de represalia4”; la investigación de adenosina en los diversos órganos ha sido de gran relevancia, incluyendo su participación en cáncer mediante sus propios receptores.5
Receptores purinérgicos:
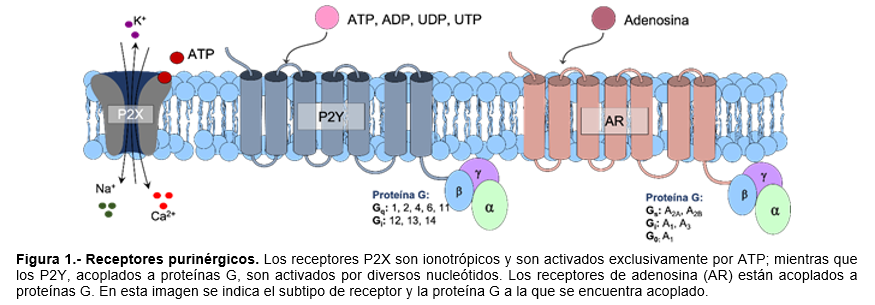
Los receptores purinérgicos, desde el punto de vista evolutivo, son muy antiguos.6 Estos pueden clasificarse en función de sus activadores o estimuladores, siendo los P1 aquellos activados por adenosina y, los P2 por una variedad de nucleótidos.7 (Figura 1).

Receptores para adenosina (P1)
Los receptores para adenosina tienen la estructura clásica de un receptor metabotrópico acoplado a proteína G, con una α-helicoidal de siete segmentos transmembrana, un extremo N-terminal extracelular, tres bucles extracelulares, un extremo C-terminal intracelular y tres bucles intracelulares.8 Comúnmente se denominan receptores para adenosina porque son activados fisiológicamente por niveles nanomolares de adenosina extracelular.9 Existen cuatro subtipos de receptores nombrados en orden de descubrimiento: A1, A2a, A2b y A3.10 Estos receptores están codificados por los genes: ADORA1, ADORA2A, ADORA2B y ADORA3.11 Los receptores A1 y A2a poseen una alta afinidad por la adenosina, mientras que los receptores A2 b y A3 muestran una afinidad relativamente menor.
Receptores para nucleótidos (P2)
Los receptores P2 (Cuadro I) se dividen en dos subfamilias: receptores P2X y P2Y, en función de su farmacología y de las diferentes vías de señalización con las que están asociadas. Los receptores P2X están formados por tres subunidades que le permiten formar receptores homoméricos o heteroméricos.12 Se expresan en muchos tejidos, donde participan en varias funciones que incluyen la transmisión sináptica, contracción muscular, agregación plaquetaria, inflamación, activación de macrófagos, diferenciación, proliferación, dolor neuropático, entre otras.13 Estos receptores son canales catiónicos no selectivos, y en condiciones fisiológicas dan lugar a la entrada de Na+ y Ca2+ y al eflujo de K+, lo que conduce a la despolarización de la membrana plasmática y a un incremento en las concentraciones de Na+ y Ca2+ intracelular.14
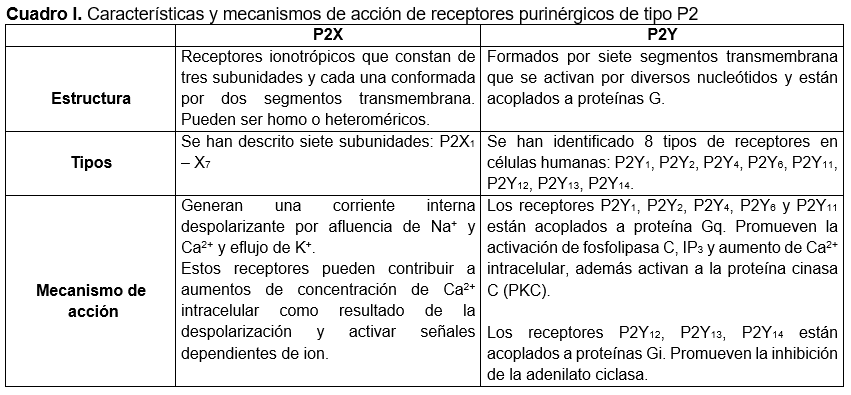
Los receptores P2Y son activados por ATP y están acoplados a proteínas G, en células humanas se han descrito ocho subtipos7: P2Y1, P2Y2, P2Y4, P2Y6, P2Y11, P2Y12, P2Y13, P2Y14. Se han asociado varias vías secundarias de transducción de mensajeros en la señalización de receptores P2Y. Estos incluyen la activación de fosfolipasa C, inhibición o estimulación de la adenilato ciclasa y la modulación directa de la función de algunos canales iónicos.15 A diferencia de los receptores P2X, quienes responden únicamente a ATP como ligando fisiológico, los receptores P2Y pueden responder a diversos nucleótidos derivados de las púrinas y piramidas como ADP, UDP y UTP, y con menor potencia a otros nucleótidos GTP e ITP, al menos en células humanas.16
Liberación y metabolismo de ATP y adenosina en el microambiente tumoral
El microambiente tumoral es un entorno dinámico y un sitio privilegiado. Su composición bioquímica y celular es de primordial para la regulación del metabolismo, proliferación, motilidad y diseminación de las células tumorales.17 El microentorno del tumor se caracteriza por ser hipóxico y presentar concentraciones inusualmente altas de ATP y adenosina.18 Se ha propuesto que la hipoxia es debida a la alta demanda de oxígeno de células en proliferación.19 En esta situación de hipoxia, el factor de transcripción inducible por hipoxia 1 (HIF1) aumenta la expresión de las ectonucleotidasas CD39 (ecto-nucleósido trifosfato difosfohidrolasa 1) y CD73 (5’ectonucleotidasa), estas incrementan la producción de adenosina.20 Por otra parte, la adenosina activa a los receptores A2a y A2b, que regulan negativamente a la adenosina cinasa (AK) y en consecuencia se inhibe la conversión de adenosina a AMP.21,22
En un individuo sano, el ATP está presente en el rango de 5 a 10 mM en los compartimentos intracelulares, mientras que, la concentración extracelular de ATP está estimada en un rango de 10 - 100 nM en general.23 Sin embargo, en el microambiente tumoral, las concentraciones de ATP extracelular pueden alcanzar concentraciones en el orden micromolar.24 El uso de la sonda luciferasa de la membrana plasmática (pmeLUC) ha demostrado que los niveles de ATP extracelular oscilan entre 50 – 200µM en células cancerígenas. La sonda pmeLUC es incorporada en las células HEK293 (células renales de embrión humano) en la porción extracelular de la membrana plasmática y permite evidenciar las concentraciones de ATP liberadas por la célula, toda vez que el medio extracelular se encuentra libre de ATP.25 La liberación de ATP puede producirse en respuesta a diversos estímulos fisiológicos o en respuesta a condiciones patológicas como la hipoxia, deshidratación o mecanismos de lesión celular.26 El ATP también es liberado al espacio extracelular a través de la muerte celular a causa de eventos estresante, por ejemplo: infamación, hipoxia, estrés mecánico.27 El ATP y sus productos de hidrólisis (ADP, AMP, adenosina) actúan como moléculas de señalización a través de su unión a receptores purinérgicos específicos.28 De manera normal, la adenosina extracelular es generada por la desfosforilación del ATP a través de las ectonucleotidasas CD39/CD73 y su concentración extracelular es regulada dentro de un rango de 30 – 200 nM.29 Sin embargo, en el microambiente tumoral, las concentraciones de adenosina oscilan entre 1000 y 10,000 nM y se considera que dichas concentraciones podrían ayudar a la progresión del cáncer.30
El ATP se acumula en la luz de las vesículas intracelulares que secretan sus contenidos mediante exocitosis, ya sea frente a un estímulo o por vía constitutiva.31 La acumulación de ATP dentro de los gránulos secretores está mediada por el transportador de nucleótidos vesiculares a expensas del gradiente electroquímico generado por la bomba de protones ATPasa vacuolar granular.32 En muchos tipos de células (diferentes a las neuronas), la liberación de nucleótidos se produce independientemente de la exocitosis de vesículas.33 Sin embargo, se ha propuesto que las vías más probables para la liberación de ATP no vesicular, es a través de canales selectivos de aniones, como los canales de maxi anión, los canales aniónicos regulados por volumen15 y los homólogos humanos del gen de Drosophila melanogaster localizado en el locus no volador, o proteínas de la membrana plasmática que forman poros no selectivos, como las conexinas, la panexina 1 y el receptor P2X7.17 Las células tumorales expresan al menos algunas de estas vías. Entre estos mecanismos, se cree que la panexina 1 es la vía principal para el flujo de salida de ATP,34,35 en la mayoría de los tipos celulares, y es considerada vital en la señalización purinérgica, por dos características principales. La primera, debido a que se activa por receptores P2 y la endotoxina bacteriana que actúa sobre la caspasa-11 o durante la apoptosis inducida por fármacos quimioterapéuticos a través de la caspasa-3.36 La segunda, es debida a que experimenta una inhibición por retroalimentación a través de la unión de ATP a un sitio de baja afinidad, ubicado en su dominio extracelular, lo que evita la acumulación excesiva y potencialmente peligrosa de ATP en el espacio pericelular.37 Otra vía propuesta de liberación de ATP es a través de los receptores P2X7, uno de los receptores más expresados en los tumores y en el sistema inmunitario.38 En el microambiente tumoral, su actividad condiciona la función de diferentes subconjuntos celulares y puede tener influencias en la progresión de la enfermedad como promotor o inhibidor.39 En diferentes células tumorales, se ha observado que la expresión del receptor P2X7 está asociada con la transición epitelio-mesénquima y su activación por ATP regula las capacidades de invasión y migración de las células cancerígenas.40
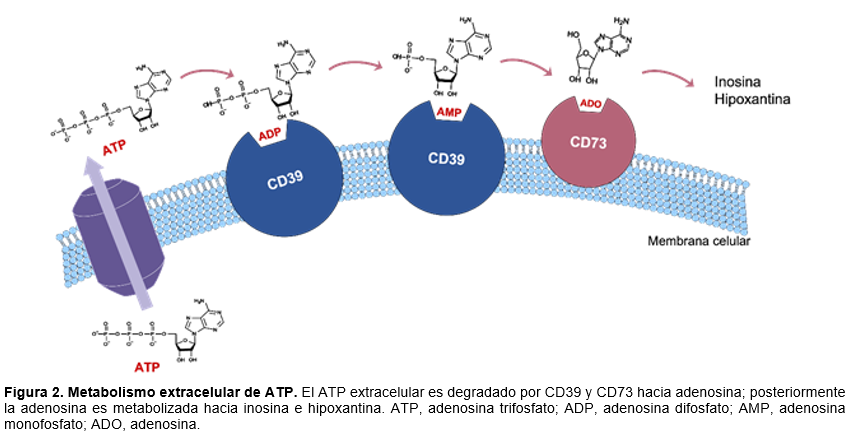
Después de la transducción de la señal, el ATP extracelular es inactivado rápidamente en adenosina41 (Figura 2). En el espacio extracelular, el ATP es convertido en ADP y AMP por la enzima la CD39, una proteína integral de membrana dependiente de Ca2+ y Mg2+.42 Posteriormente, la CD73 convierte el AMP en adenosina a través de un proceso de desfosforilación.43 La CD73 es un dímero anclado a la membrana plasmática a través de un residuo de serina localizado en el C-terminal, unido a glicosilfosfatidil inositol (GPI), sin segmentos de proteína incrustados en la membrana.44 La adenosina es reconocida por los receptores P1 o bien es inactivada en la superficie celular a través de la ecto-adenosina desaminasa (ADA) y purina nucleósido fosforilasa en inosina e hipoxantina y posteriormente en ácido úrico por la vía de las xantinas.45
Señalización purinérgica en el microambiente tumoral:
Los receptores purinérgicos P1 y P2 activan diversas vías de señalización relacionadas con el cáncer,46 por una parte, el ATP extracelular activa a los receptores P2X y P2Y y por otra la adenosina a los receptores para adenosina P1 (Figura 3). Los receptores purinérgicos P2Y se han descrito en vías de señalización relacionadas con el cáncer, como la invasión y diseminación metastásica al promover la migración o quimiotaxis, por ejemplo: en cáncer de mama y de próstata.10 Particularmente, el receptor P2Y2, mediante la vía de señalización PI3K/AKT está involucrado en la proliferación celular de osteoblastos47 y de células MCF-7.48 Además de estos eventos de proliferación, también su activación se ha relacionado con la invasión en cáncer de próstata49 y de mama.50 Por otra parte, el ATP también promueve la supervivencia de líneas celulares de cáncer de pulmón de células no pequeñas mediante el receptor P2Y4.51 Mientras que en cáncer colorrectal se ha asociado al receptor P2Y6, como promotor de la oncogénesis al inhibir la apoptosis;52 interesantemente, su expresión se encuentra disminuida en cáncer gástrico en comparación con tejidos normales, por el contrario, la expresión P2Y2 y P2Y4 se encuentran incrementada.53
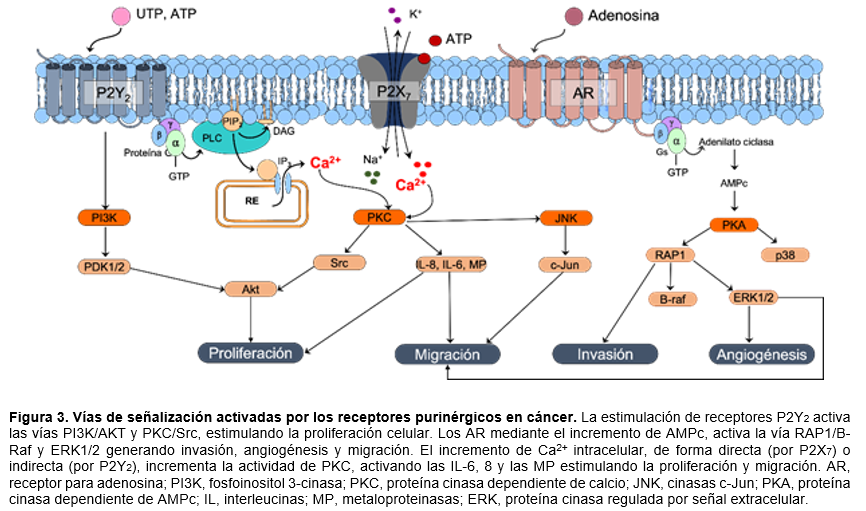
Se han descrito varios receptores de tipo P2X en las células tumorales con diversas funciones, entre ellos, los P2X1, 4 y 5, especialmente en cánceres hematológicos.54 Uno de los receptores que más participación tiene en los procesos tumorales es el receptor P2X7, quien se comporta de manera bifuncional dependiendo del nivel de activación y el tipo de célula, desencadenando la muerte celular o, como alternativa, apoya el crecimiento tumoral.55 La activación sostenida de P2X7 a bajas concentraciones provoca el aumento moderado de la concentración de Ca2+ mitocondrial, la estimulación de la fosforilación oxidativa y el aumento de la generación de ATP.56 Además, la activación de este receptor ha sido asociado con la promoción de la metástasis a través de la señalización PI3K/AKT/GSK3β/β-catenina y mTOR/HIF1α/VEGF.55 También, se ha mostrado que su activación puede estimular la vía de NF-kB, JNK y ERK1/2 y AMPK, participando en la regulación del crecimiento, apoptosis, migración e invasión de células tumorales.57
Por su parte, la adenosina extracelular al unirse a alguno de sus receptores (A1, A2a, A2b y A3) puede generar importantes cambios a nivel intracelular, por ejemplo, los receptores A2a y A2b ocasionan un incremento en la actividad de la adenilato ciclasa, acompañada de un incremento del AMP cíclico.58 La estimulación del receptor A2a también podría ocasionar la producción de una señal inmunosupresora que inhibe a las células T, NK (natural killer), NKT (Linfocitos T natural killer), macrófagos, células dendríticas y neutrófilos.19 Además, se han descrito diversas actividades de los receptores de adenosina en las células tumorales, como son: aumento de la supervivencia por estimulación de AKT, ERK1/2 e inactivación de Bad por activación del receptor A1; así como, incremento de proliferación mediante la fosfolipasa C, PKC, AKT, ERK1/2, JNK, p38 por activación de los receptores A1, A2a, A2b y A3.58
Adaptaciones metabólicas en el microambiente tumoral
El reconocimiento inicial de que las células cancerosas cuentan con propiedades metabólicas anormales se remonta a los trabajos de Otto Warburg59. En presencia de oxígeno, la mayoría de los tejidos normales metabolizan la glucosa hasta piruvato a través de la glucólisis y luego se oxida CO2 en la mitocondria mediante la fosforilación oxidativa, mientras que en condiciones anaeróbicas se produce lactato59. Sin embargo, Warburg observó que, a diferencia de las células normales, los tumores de proliferación rápida metabolizan glucosa a lactato en presencia de oxígeno, a este fenómeno se le denominó efecto de Warburg60.
En tejido sano, además de los productos glucolíticos, los intermedios del ciclo de Krebs también se utilizan como precursores para la síntesis de macromoléculas.61 En células tumorales, se ha observado que presentan un aumento en la vía de la glucólisis y en consecuencia la producción de ATP. Además de hacer uso de la glucólisis para la producción de lactato, las células tumorales también, tienen la capacidad de producir energía a través de la oxidación de glucosa en la mitocondrial.64 Lo anterior genera una alta tasa de glucólisis, y generan mayor ATP a través de la función mitocondrial, que participa en la proliferación y carcinogénesis.63
Además de los sustratos derivados de la glucólisis, los ácidos grasos (β-oxidación) y aminoácidos pueden suministrar sustratos al ciclo de Krebs (acetil-CoA y sus equivalentes) para mantener la producción de ATP mitocondrial.64 Las vías que complementan al ciclo de Krebs se denominan vías anapleróticas y generan metabolitos intermediarios que pueden introducirse en el ciclo y contribuir a la formación de ATP.65 Dentro de estas vías anapleróticas se encuentran dos vías particulares: la glutaminólisis (producción de α-cetoglutarato a partir de glutamina) y carboxilación de piruvato (producción de oxalacetato a partir de glucosa o piruvato). Mediante la glutaminólisis, las células cancerosas pueden producir ATP a partir de la incorporación de α-cetoglutarato al ciclo de Krebs,66 mediante la generación de NADH and FADH2. Se ha demostrado que los procesos de captación y el uso de glutamina están elevados en varios tipos de cáncer, principalmente para la síntesis de lípidos de novo en condiciones hipóxicas comúnmente observadas en tumores.67 Por lo que la importancia de esta vía radica en que se pueden obtener diversos metabolitos a partir de la glutamina (glutamato, α-cetoglutarato y aspartato) dependiendo de las necesidades de la célula. A partir de la glutamina (a través de la glutaminasa) las células obtienen glutamato, el cual puede ser convertido a α-cetoglutarato y generar aspartato (por el aspartato transaminasa), otro aminoácido que participa en la biosíntesis de nucleótidos y con ello esta vía participa en la proliferación celular en diversos tipos de cáncer.68 El glutamato, además de participar en vías energéticas, también tiene un papel fundamental al ser usado para la producción de novo de glutatión (tripéptido formado por glutamato, cisteína y glicina) en células cancerígenas.69 Por lo cual, el glutamato participa en el balance redox y algunos autores sugieren que la reducción de antioxidantes en las células tumorales podría ser otra estrategia en la terapéutica contra el cáncer.70 El aspartato, se ha observado que, en condiciones de deprivación de glutamina, es capaz de rescatar el arresto de la fase S en células cancerígenas.71 Por ello, las enzimas que participan en la glutaminólisis han tomado relevancia como posibles blancos terapéuticos coadyuvantes contra el cáncer. Dentro de los aminoácidos, la glutamina ha tomado mayor importancia,72 ya que es el aminoácido libre más abundante y está involucrada en un importante número de vías energéticas. Además, se ha descrito que regula glutamina es necesaria para la progresión de la fase G1 hacia la fase S del ciclo celular.73
Otra de las características relevantes de las células tumorales es que residen en ambientes privados de oxígeno.74 El HIF-1 es el responsable de la adaptación a esta condición e incrementa la expresión de genes relacionados con la glucólisis como lactato deshidrogenasa A (LDHA) y piruvato deshidrogenasa quinasa-1 (PDK1), estas últimas desvían el flujo de piruvato a lactato. La LDHA cataliza la conversión de piruvato a lactato de manera directa o indirectamente a través de la PDK1 que regula negativamente la entrada de piruvato a la mitocondria.75 Las células tumorales exhiben glucólisis aeróbica debido a la activación de oncogenes, la pérdida de supresores de tumores y la estimulación de la vía PI3K-AKT.62 Esta vía de señalización se encuentra alterada consistentemente en diversos tipos celulares, la cual es altamente sensible a la estimulación extrínseca por factores de crecimiento, y la actividad de oncogenes y supresores de tumores.76 Desempeña un papel importante en la regulación de las adaptaciones metabólicas que favorecen el crecimiento celular.77 Un efecto de su activación es la promoción del metabolismo glucolítico a través de la translocación de los transportadores de glucosa en la membrana mediada por AKT y la activación de la hexoquinasa y fosfofructoquinasa dependiente de AKT.78
Las células tumorales viven en un microambiente ácido con poca disponibilidad de oxígeno, por lo que reorganizan sus vías metabólicas para la generación de energía y producción de intermediarios metabólicos. Como se mencionó previamente, uno de los receptores que con mayor frecuencia se encuentra sobreexpresado en diversos tipos de cáncer es el P2X7.35 Este receptor regula positivamente al transportador de glucosa GLUT-1 y enzimas de la glucólisis, además inhibe la actividad de la piruvato deshidrogenasa; también tiene la capacidad de incrementar la abundancia de AKT/PKB fosforilada y el HIF-1α,79 y participa en el incremento de las reservas intracelulares de glucógeno; es decir, este receptor tiene la capacidad de reprogramar el metabolismo celular.79
Receptores purinérgicos, terapéutica contra el cáncer.
Los receptores purinérgicos se encuentran principalmente en tejidos metabólicamente activos80, mientras que el ATP se encuentra incrementado en el microambiente tumoral, proveniente de células necróticas y tumorales, como resultado de su metabolismo celular. Las concentraciones altas de ATP extracelular conllevan al incremento secundario de adenosina, que también favorece al desarrollo y progresión del cáncer.80 La activación de receptores purinérgicos expresados en diversos órganos puede promover la proliferación y la transición epitelio-mesénquima.81 Se ha propuesto que reducir la concentración de ATP extracelular podría ser beneficioso, dado que se podría reducir la adenosina y la estimulación consecuente de células tumorales. Contrariamente, también se ha propuesto aumentar súbitamente su concentración para iniciar la citotoxicidad dependiente de ATP.23 Se han realizado estudios clínicos donde se administró ATP intravenoso, el cual fue bien tolerado por pacientes con cáncer, generando mejoría de la caquexia asociada al tumor.82 Sin embargo, uno de los problemas con la administración de ATP para tratamiento contra el cáncer, es su alta tasa de degradación, por lo que es necesario el estudio de administración de inhibidores de CD39 y CD73, para así, promover una respuesta inmunitaria antitumoral efectiva.83 Para alcanzar la efectividad de estos tratamientos es necesario realizar más estudios de investigación básica y clínica que contemplen el microambiente tumoral, e incluso reducir los índices de quimiorresistencia asociados con la participación de ATP y sus metabolitos.
En nuestro laboratorio, trabajamos con la línea celular LP07, proveniente de un adenocarcinoma pulmonar originado espontáneamente en ratones BALB/c84 y se ha observado la presencia de receptores P2X1, P2Y2, P2Y4 en membrana plasmática y núcleo mediante ensayos de inmunofluorescencia (datos no publicados). Su activación mediante la administración de ATP favorece el incremento de calcio intracelular y otra serie de cambios los cuales nos podrían sugerir que se están activando vías de señalización que participan en procesos de proliferación, migración, invasión y supervivencia de estas células tumorales, como se ha descrito en otros tipos de cáncer.
La adenosina es un regulador metabólico e inmunitario clave,85 de hecho, desempeña un papel importante en el establecimiento del microambiente tumoral inmunosupresor y en la progresión del cáncer. Interesantemente, la hipoxia tisular parece ser el principal factor para el aumento de los niveles de adenosina intratumoral, esta hipoxia tumoral parece ser debida a la alta demanda de oxígeno por parte de las células en proliferación.86 Aunado a ello, la hipoxia induce la expresión de las ectonucleotidasas CD39 y CD73, por lo que incrementa la producción catabólica de adenosina, además de inhibir la adenosina quinasa, impidiendo la conversión de adenosina hacia sus nucleótidos.18 Por lo anterior, se ha propuesto la inactivación de ectonucleotidasas en la inmunoterapia contra el cáncer.
Conclusión
La función principal del ATP es almacenar, transportar y suministrar energía para las diferentes reacciones químicas a nivel celular, y tiene una importante participación en las vías de señalización extracelular a través de receptores purinérgicos expresados en células tumorales. Además, su metabolito, la adenosina, también forma parte de la vía de señalización de nucleótidos y nucleósidos, que en conjunto contribuyen a la formación, proliferación, invasión y migración de células tumorales. Por todo lo anterior, resulta fundamental entender la fisiopatología de estas sustancias y explorar el campo terapéutico en la señalización purinérgica, con la finalidad de disminuir el crecimiento tumoral o bien, erradicarlo.
Referencias