Rev Med UAS
Vol. 14: No. 1. Enero-Marzo 2024
ISSN 2007-8013
Martín Adrián Bolívar-Rodríguez1,*, Carlos Rubén Mendoza-Chang1, Marcel Antonio Cázarez-Aguilar1, Adrián Pámanes-Lozano1, Guadalupe López-Manjarrez2.
Culiacán, Sinaloa, México.
*Autor de correspondencia: Dr. Martín Adrián Bolívar-Rodríguez,
Correo electrónico: bolivarmartin64@hotmail.com
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v14.n1.003
Texto Completo PDFRecibido 10 de abril 2023, aceptado 12 de septiembre 2023
RESUMEN
Objetivo: Evaluar la proteína C reactiva como predictor de colecistectomía difícil en colecistitis aguda, determinar los factores de riesgo para la colecistectomía difícil y el porcentaje de conversión de colecistectomía laparoscópica a cirugía abierta en hospital de segundo nivel. --- Material y métodos: Estudio observacional, transversal y retrospectivo de 100 casos consecutivos con diagnóstico de colecistitis aguda y proteína C reactiva preoperatoria, que fueron sometidos a colecistectomía laparoscópica en el período de marzo 2019 y octubre 2021 en hospital de segundo nivel. --- Resultados: De los 100 casos, se detectó colecistectomía difícil en un total de 39 (39%) pacientes, de los cuales el 5% se convirtió a cirugía abierta. La curva ROC determinó el valor del área bajo la curva para la PCR de 0.526 con un valor significativo de 0.666 y se estableció el mejor punto de corte de 3.5 mg/dl. Se obtuvieron sensibilidad de 59.0% (43.3-72.9, IC95%), especificidad de 49.2% (37.1-61.4, IC 95%), valor predictivo positivo de 42.6% (30.3-55.8, IC95%), valor predictivo negativo de 65.2% (50.8-77.3, IC95%), proporción de falsos positivos de 50.8% (38.6-62.9, IC95%), y proporción de falsos negativos de 41.0 (27.1-56.6, IC95%), con exactitud de 53% (43.3 – 62.5, IC 95%). --- Conclusiones: la proteína C reactiva de forma individual y a un punto de corte de 3.5 mg/dL no representa un marcador predictivo óptimo para la colecistectomía difícil en pacientes con colecistitis aguda.
Palabras clave: Colecistitis aguda, proteína C reactiva, colecistectomía laparoscópica difícil, predicción.
ABSTRACT
Objective: To evaluate C-reactive protein as a predictor of difficult cholecystectomy in acute cholecystitis, to determine the risk factors for difficult cholecystectomy and the percentage of conversion from laparoscopic cholecystectomy to open surgery in a second-level hospital. --- Material and methods: Observational, cross-sectional, and retrospective study of 100 consecutive cases with a diagnosis of acute cholecystitis and preoperative C-reactive protein, who underwent laparoscopic cholecystectomy in the period of March 2019 and October 2021 in a second-level hospital. Results: Of the 100 cases, difficult cholecystectomy was detected in a total of 39 (39%) patients, of which 5% converted to open surgery. The ROC curve determined the area under the curve value for CRP of 0.526 with a significant value of 0.666 and the best cut-off point of 3.5 mg/dl was established. Sensitivity of 59.0% (43.3-72.9, 95% CI), specificity of 49.2% (37.1-61.4, 95% CI), positive predictive value of 42.6% (30.3-55.8, 95% CI), negative predictive value of 65.2% (50.8-77.3, 95% CI), proportion of false positives of 50.8% (38.6-62.9, 95% CI), and proportion of false negatives of 41.0 (27.1-56.6, 95% CI), with accuracy of 53% (43.3-62.5, 95% CI). --- Conclusions: C-reactive protein individually and at a cut-off point of 3.5 mg/dL does not represent an optimal predictive marker for difficult cholecystectomy in patients with acute cholecystitis.
Keywords: Acute Cholecystitis, C reactive protein, difficult laparoscopic cholecystectomy, prediction.
Introducción
La colecistitis aguda (CA) es la inflamación de la vesícula biliar, originada por obstrucción del conducto cístico o la disfunción del vaciamiento de la vesícula, comúnmente ocasionada por la litiasis vesicular, ya que aumentan la probabilidad de la obstrucción, aunque también existen otros factores etiológicos como procesos infecciosos, neoplásicos, isquémicos y otros.
Se presenta más frecuentemente en mujeres, edad mayor de 40 años, obesidad y edad reproductiva.2
El diagnóstico de CA, requiere la presencia de signos locales (dolor en hipocondrio derecho, signo de murphy, plastrón, etc.), signos sistémicos de inflamación (fiebre, leucocitosis, aumento de proteína C reactiva, etc.), y un estudio radiológico confirmatorio (ultrasonido, tomografía, etc.).3
La CA tiene como característica el dolor abdominal en hipocondrio derecho como uno de sus síntomas más comúnes,2 siendo el signo de Murphy el encontrado cuando la pared de la vesícula biliar esta inflamada, con una sensibilidad de 50-65% y especificidad del 79% para el diagnóstico de CA.4
Entre los estudios de imagen para diagnosticar CA están el ultrasonido, la tomografía y gammagrafía hepatobiliar con ácido iminodiacético, siendo el ultrasonido el estudio de primera línea con una sensibilidad de 71%, especificidad de 85% y con una precisión de 0.83.5 Los hallazgos en el ultrasonido en CA son la pared vesicular ≥ 5 mm, líquido perivesicular, dolor a la presión sobre la vesícula (signo de Murphy ultrasonográfico), volumen aumentado de la vesícula biliar, litiasis, entre otras.6
Ahora bien, como signo sistémico de inflamación, la proteína C reactiva (PCR), como segunda proteína que puede aumentar rápidamente ante una lesión tisular como reactante de fase aguda, sintetizada en el hígado y con una vida media de 19 horas, por lo regular aumenta ante cualquier proceso que produce inflamación ya sea por infección, traumático, neoplásico, isquémico, etc.7
En CA, al ser un proceso inflamatorio agudo, también se ha encontrado elevada la PCR y es considerada para su diagnóstico cuando tiene valor mayor de 3 mg/dL,3 considerándose valores normales de 0.1 hasta 1 mg/dL.8
Establecido el diagnóstico de CA, el tratamiento de elección es la colecistectomía laparoscópica, que si bien, es un procedimiento de mínima invasión muy frecuente, puede tener sus complicaciones inherentes a la cirugía, como lo son: lesión de la vía biliar de cualquier complejidad (0.1 a 0.6%), sangrado significativo, colección intraabdominal (infección del sitio quirúrgico), lesión de vasos mayores y menores (0.9 por 1,000), lesión intestinal (1.8 por 1,000), así como también complicaciones médicas como tromboembolia pulmonar, atelectasia, neumonía, entre otras.9
La probabilidad de presentarse alguna complicación aumenta con la presencia de una colecistectomía difícil, referida como la resección quirúrgica de la vesícula biliar con condiciones preexistentes propias de la vesícula, órganos contiguos a la vesícula o del paciente, las cuales no permitan una disección fácil, rápida y cómoda de la vesícula lo que puede producir hemorragia significativa y prolongación del tiempo quirúrgico.10
Madni TD et al.11 conforme los hallazgos intraoperatorios de la severidad de la CA elaboraron la clasificación de Parkland en 5 grados: grado 1, apariencia normal de la vesícula y sin adherencias; grado 2, adherencias menores en el cuello o en la parte inferior de la vesícula; grado 3, adherencias mayores en el cuello o en la parte inferior de la vesícula; grado 4, adherencias que oscurecen la mayor parte de la vesícula, además, grados I y Ill con anatomía anormal del hígado, vesícula intraherática o lito impactado (Mirizzi); grado 5, presencia de perforación, necrosis e imposibilidad de visualizar la vesícula por adherencias. En base a esta clasificación en este estudio se asignó como referente a los grados 3,4 y 5 como colecistectomía difícil.
Los factores de riesgo para que se presente una colecistectomía difícil son: CA, hombres, edad ≥ 65 años, diabetes, obesidad, cirugía abdominal previa, historia prolongada de colecistitis, leucocitosis y sepsis. Es importante considerar como factor de riesgo al equipo quirúrgico que llevará cabo la cirugía sobre todo el cirujano, debido a que del conocimiento del procedimiento y su habilidad para reconocer y resolver eventualidades intraoperatorias dependerá en gran medida para considerar una colecistectomía difícil.12
Cuando se presenta colecistectomía difícil es recomendable llevar a cabo tres procederes: realizar colangiografía intraoperatoria ayudando a identificar la vía biliar; solicitar la intervención de otro cirujano con más experiencia; convertir a cirugía abierta.
Es meritorio señalar que estos pueden aplicarse en forma individual o todos juntos, siempre antes y no después de la lesión.13
La conversión a cirugía abierta se ha clasificado en tipo 1 cuando se realiza forzada por daño colateral a un órgano vecino, se tiene hemorragia incontrolable o lesión de la vía biliar, y tipo 2, cuando se realiza electiva por falta de progresión de la cirugía y disección difícil y riesgosa, con prolongación del tiempo quirúrgico.14
El objetivo principal del este estudio fue evaluar la proteína C reactiva como predictor de colecistectomía difícil en colecistitis aguda y como objetivos secundarios, determinar los factores de riesgo para la colecistectomía difícil y el porcentaje de conversión de colecistectomía laparoscópica a cirugía abierta en hospital de segundo nivel.
Material y métodos
Estudio observacional, descriptivo, transversal y retrospectivo en el que se analizaron los expedientes de 100 pacientes que ingresaron en forma consecutiva del sexo masculino y femenino, edad de 18 años y mayor con diagnóstico de CA conforme los criterios clínicos, de laboratorio e imagen, que tuvieron determinación de PCR preoperatoria y que fueron sometidos a colecistectomía laparoscópica en el período comprendido entre marzo del 2019 y octubre del 2021 en un hospital de segundo nivel y que fue reconvertido en hospital COVID a partir de abril de 2020.
Se excluyeron los pacientes con expediente y datos requeridos incompletos, que no tuvieron determinación de PCR preoperatoria y que no presentaron comorbilidad que condicionara elevación de PCR, así como a los que se realizó la colecistectomía abierta de primera instancia. Se eliminaron los pacientes que no aceptaron tratamiento quirúrgico.
Como se mencionó en la introducción, para este estudio se consideró como referencia de colecistectomía difícil la determinación intraoperatoria del cirujano (cirujano y/o residente de Cirugía General supervisado por cirujano) en base a la severidad de la CA conforme los 5 grados de la clasificación de Parkland, asignando a los grados 3,4 y 5 como colecistectomía difícil.
Se recopilaron y recolectaron los datos de los expedientes y se vertieron en plantilla de Excel, para su posterior análisis y presentación estadística.
Análisis estadístico
Se calculó una muestra de 520 pacientes del grupo negativo y 53 pacientes del grupo positivo para estimar el área bajo la curva ROC con un error de 0.05 usando una prueba Z bilateral y un nivel de significancia de 0.5%. Se supone la razón de la desviación estándar entre los grupos de 1. Se asume una tasa de colocación del 10% para el grupo positivo. Cálculo de tamaño de muestra fue de n=573 pacientes.
Se utilizaron las pruebas de Chi cuadrada, T de Student, U de Mann Whitney, para comparar las diferentes varibales en relación con la colecistectomía difícil. La curva ROC y área bajo la curva, para determinar el punto de corte de la PCR y por último la sensibilidad y especificidad de la prueba.
Resultados
Se analizaron 100 casos de pacientes que cumplieron con los criterios de inclusión, de los cuales 71 (71%) eran mujeres y 29 (29%) eran hombres. De todos los pacientes, 28 tenían hipertensión arterial sistémica (HAS), 10 pacientes tenían diagnóstico de diabetes mellitus, 38 tenían algún grado de obesidad, el signo de Murphy fue encontrado en 71 pacientes, solo 11 presentaron fiebre y en 2 pacientes se optó por realizar conversión de cirugía laparoscópica a abierta.
De los 100 casos, se detectó colecistectomía difícil en un total de 39 (39%) pacientes, de los cuales el 5% se convirtió a cirugía abierta.
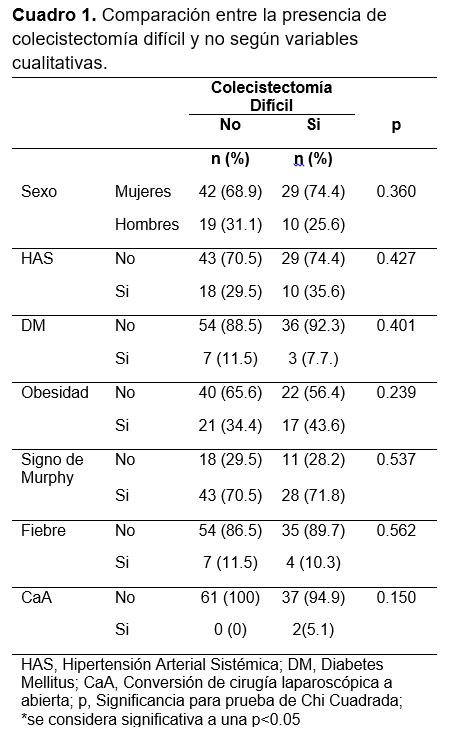
Se realizó una comparación de las variables cualitativas (sexo, HAS, DM, obesidad, signo de Murphy, fiebre y conversión a cirugía abierta) de acuerdo a la presencia de colecistectomía difícil por medio de Chi cuadrada, con el objetivo de determinar si alguna de estas variables representaba algún factor asociado a la colecistectomía difícil. Se encontró que ninguna de las variables mostró una diferencia estadísticamente significativa entre grupos (Cuadro 1).

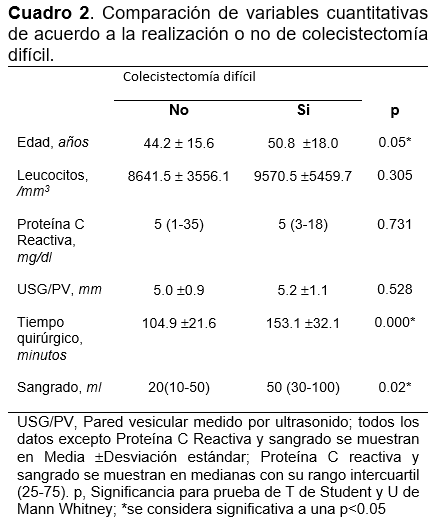
Mediante prueba T de Student para comparar las medias y desviaciones estándar de aquellos con y sin colecistectomía difícil según variables cuantitativas paramétricas (edad (años), leucocitos, pared vesicular por ultrasonido y tiempo quirúrgico). También se realizó la misma comparación utilizando U de Mann Whitney para las variables no paramétricas (PCR y sangrado) (Cuadro 2). Los resultados muestran que los pacientes con colecistectomía difícil eran significativamente mayores (50.8 ± 18, p < 0.05) que los pacientes a los que no se detectó colecistectomía difícil y que el tiempo quirúrgico así como el sangrado fue significiativamente mayor en el grupo con colecistectomía difícil.
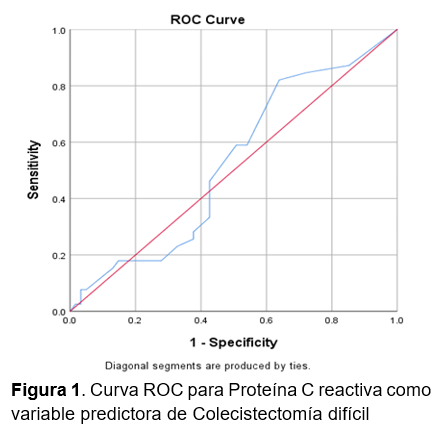
La curva ROC (Receiving Operating Curve) para la variable PCR determinó el valor del área bajo la curva (AUC) de 0.526 con un valor significativo de 0.666. Con base en los resultados, se estableció el mejor punto de corte de 3.5 mg/dl con una sensibilidad de 59% y una especificidad de 46%. (Figura 1).
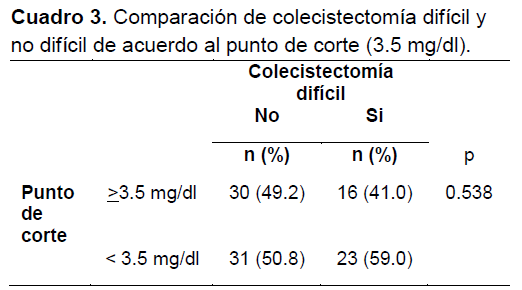
Con este punto de corte (3.5 mg/dL) se determinó mediante prueba de Chi cuadrada que no hubo diferencias significativas entre frecuencia de presencia de colecistectomía difícil dependiendo del grupo (≥ 3.5 mg/dL y < 3.5 mg/dL) (Cuadro 3).
Por último, se realizó una tabla de comparación de prueba diagnóstica (PCR) con la prueba de referencia utilizada, para determinar la validez de la prueba (Cuadro 4).
Se obtuvo una sensibilidad del 59.0% (43.3-72.9, IC95%) y una especificidad de 49.2% (37.1-61.4, IC 95%). Se determinó el valor predictivo positivo 42.6% (30.3-55.8, IC95%) y el valor predictivo negativo 65.2% (50.8-77.3, IC95%); también se calcularon la proporción de falsos positivos alcanzando un 50.8% (38.6 – 62.9, IC95%), y la proporción de falsos negativos a un 41.0 (27.1 – 56.6, IC95%), finalmente demostrando una exactitud de 53% (43.3 – 62.5, IC 95%).

Discusión
En el estudio de Vargas Oliva et al.15 la mayoría de los casos de colecistitis eran en mujeres y el IMC así como las enfermedades asociadas no resultaron factores de riesgo para colecistectomía difícil, estos resultados concuerdan con los encontrados en el presente estudio. En contraste, Ruiz Patiño et al.16 explican en su trabajo que los pacientes de edad avanzada, los de sexo masculino y la presencia de comorbilidades son factores predictores de colecistectomía difícil, incluso menciona que la presencia de diabetes mellitus en el paciente es un factor condicionante para complicaciones en la cirugía. También menciona que la presencia de síntomas inflamatorios (fiebre mayor de 38 °C, dolor que no cede con analgésicos/ antiespasmódicos, masa subcostal palpable) anticipan la posibilidad de enfrentar un caso difícil. Estos resultados también han sido reportados por Lasprilla y Torres en su trabajo.17
El sangrado fue significativamente mayor en el grupo con colecistectomía difícil. Sierra et al.18 mencionan que dentro de los factores relacionado con la presentación de colecistectomías difíciles y de complicaciones postquirúrgicas se encuentra el sangrado profuso, esto coincide con nuestros hallazgos.
En lo que respecta a la identificación del signo de Murphy como un factor de riesgo para dificultades en la cirugía, en el presente trabajo no se encontró una asociación entre este signo y el desarrollo de colecistectomía difícil, sin embargo, Chinchilla et al.19 demostraron que la presencia de Signo de Murphy si era un factor de riesgo asociado sobre todo en las cirugías de urgencia. Por otro lado, los autores mencionaban que la conversión de cirugía laparoscópica a abierta era un factor de riesgo para complicaciones y colecistectomía difícil, en el presente trabajo no se reportaron estos resultados.
En relación con la identificación de factores que pudieran predecir las complicaciones en las colecictectomía difícil; Menacho et al.20 desarrollaron un Score SPRECLAD para predicción de colecistectomías difíciles considerando las variables edad, sexo, antecedentes de hospitalización, IMC, cicatriz en el abdomen, vesícula palpable, grosor de pared vesicular, líquido pericolecístico y cálculo enclavado; el cual demostró que tiene una adecuada probabilidad de predecir una colecistectomía laparoscópica difícil.
La PCR es una proteína plasmática circulantes que se eleva bajo condiciones de inflamación o estrés. Se ha investigado su efectividad y validez como predictora de complicaciones para diferentes situaciones, como en el caso de cirugía oncológica gástrica,21 como predictora de evolución anatomopatológica apendicular22 y en colecistectomías.23
En el presente estudio se determinó un punto de corte de 3.5 mg/dL de la PCR, la cual no mostró significancia estadística para ser considerado un predictor de colecistectomía difícil. En el estudio de Claros et al.24 los valores de PCR se asocian a estadios de gravedad clínica de CA, señalando encontrar niveles promedio para CA de 0.7mg/dL para la leve, 1.5 mg/dL para la moderada y 5.3 mg/dL para la grave. Rajab et al.25 refieren que los valores de PCR pueden estar muy elevados cuando se asocia a gangrena y cancer vesicular y señalan también que pacientes con valores por arriba de 10 mg/dL y que persisten con o sin tratamiento tienen mal pronóstico. Real-Noval et al.26 concuerdan en su estudio con la asociación de PCR elevada (>15.25 mg/dL) con colecistitis gangrenosa. Por otra parte Loccisano et al.27 realizaron un estudio sobre el papel de la PCR y la velocidad de sedimentación globular en la predicción de colecistectomía laparoscópica dificultosa encontrando que la PCR mostraba un 87,5% de sensibilidad, especificidad del 86,3%, VPP del 70% y VPN de 95%.
Limitaciones del estudio, en el transcurso del periodo 2019-2021 disminuyó notablemente el número de casos, debido a que el hospital se reconvirtió en hospital COVID, por lo que no se alcanzó el tamaño de muestra. Otra limitación es la apreciación intraoperatoria del cirujano para catalogar como colecistectomía difícil, a pesar de que se hizo en base a la clasificación de Parkland, no fue hecha por el mismo cirujano o equipo quirúrgico. Sin embargo, marca la pauta para la continuidad de un estudio prospectivo con ingreso hospitalario habitual y con la asignación de un solo equipo quirúrgico para la determinación de la colecistectomía difícil, o bien, con la captura de las imágenes de la visión laparoscópica y revisión posterior por un solo equipo de cirujanos para determinarlo.
Conclusiones
La proteína C reactiva de forma individual y a un punto de corte de 3.5 mg/dL no representa un marcador predictivo óptimo para la colecistectomía difícil en pacientes con colecistitis aguda; sin embargo, es probable que en conjunto con algún otro valor bioquímico o indicador pudiera adquirir mayor capacidad predictiva. Además, a diferencia de la evidencia disponible, la presencia de comorbilidades y el signo de Murphy no representan factores de riesgo para colecistectomía difícil, por el contrario, la edad, el sangrado y el tiempo quirúrgico si están asociados a la ejecución de una colecistectomía difícil.
Referencias