Rev Med UAS
Vol. 13: No. 4. Octubre-Diciembre 2023
ISSN 2007-8013
Juan Pablo Meza-Espinoza1*, Víctor René De la Cruz-Arias2, Noé Enríquez-Ramírez2, Julio César López-Obregón2, Evelia Leal-Ugarte1, Verónica Judith Picos-Cárdenas3
*Autor de correspondencia: Dr. Juan Pablo Meza-Espinoza PhD,
Facultad de Medicina e Ingeniería en Sistemas Computacionales de Matamoros,
Universidad Autónoma de Tamaulipas, Matamoros, Tamps., C. P. 87,349, México.
Phone and Fax: 868 204 4000. e-mail: sirol1073@yahoo.com.mx
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v13.n4.010
Texto Completo PDFRecibido 29 de enero 2023, aceptado 04 de mayo 2023
RESUMEN
La enfermedad de Parkinson (EP) es un trastorno neurodegenerativo que se caracteriza por bradicinesia, temblor de reposo, rigidez, inestabilidad postural y alteraciones del sueño. Este trastorno afecta a más de 6 millones de personas alrededor del mundo; es más frecuente en varones y se presenta aproximadamente en el 3% de las personas mayores de 65 años. En México, para el año 2023 se estimó una tasa de aproximadamente 15 casos por cada 100,000 habitantes. La EP es de etiología multifactorial; entre los factores asociados con su desarrollo se encuentran traumatismos craneoencefálicos, exposición a pesticidas y metales pesados, así como diversos genes. El objetivo de esta investigación consistió en conocer los genes y sus variantes que han sido relacionadas con la EP en población mexicana, para lo cual se realizó una revisión sistemática de artículos de estudios de casos y controles que evaluaran dicha asociación. Se encontraron 12 artículos que cumplieron con los criterios de selección. Entre todos, analizaron 32 variantes, localizadas en 17 genes. De estas, 12 variantes, distribuidas en cinco genes, mostraron asociación significativa con la enfermedad. Los genes implicados son LRRK2, MTHFR, NR4A2, SNCA y SYT11, mismos que también han sido asociados con la EP en otras poblaciones.
Palabras clave: Enfermedad de Parkinson, Variantes genéticas, Asociación.
ABSTRACT
Parkinson's disease (PD) is a neurodegenerative disorder characterized by bradykinesia, resting tremor, rigidity, postural instability, and sleep disturbances. It affects more than 6 million people worldwide; it is more common in men and occurs in approximately 3% of people over the age of 65. In Mexico, the incidence is estimated to be approximately 15 cases per 100,000 inhabitants by 2023. PD has a multifactorial etiology; factors associated with its development include cranioencephalic trauma, exposure to pesticides and heavy metals, and various genes. The aim of this research was to know the genes and their variants associated with PD in the Mexican population, for which a systematic review of articles from case-control studies evaluating this association was performed. Twelve articles were found that met the selection criteria. A total of 32 variants, located in 17 genes, were analyzed. Of these, 12 variants, distributed in five genes, showed a significant association with the disease. The genes involved are LRRK2, MTHFR, NR4A2, SNCA, and SYT11, which are also associated with PD in other populations.
Keywords: Parkinson's disease, Genetic variants, Association.
INTRODUCCION
La enfermedad de Parkinson (EP) es un trastorno neurodegenerativo que se caracteriza principalmente por alteraciones motoras como bradicinesia, discinesia, temblor de reposo, rigidez e inestabilidad postural; es el segundo trastorno neurodegenerativo más frecuente relacionado con la edad, después de la enfermedad de Alzheimer.1 La EP afecta aproximadamente al 3% de la población de 65 años y hasta el 5% de las personas mayores de 85 años. Su incidencia es dos veces más alta en hombres que en mujeres; sin embargo, las mujeres tienen una evolución más rápida de la enfermedad y una tasa de defunción más elevada.2 Las alteraciones motoras son las que caracterizan a la EP, pero a medida que la enfermedad evoluciona, estos síntomas se agravan, y pueden llegar a presentarse también alteraciones no motoras como trastornos del sueño, hiposmia, disfunción urogenital, estreñimiento, aturdimiento, visión borrosa, ansiedad, deterioro cognitivo, depresión y psicosis.3
La EP ha aumentado dramáticamente en los últimos años; de 1990 al 2015, el número de personas con EP aumentó 118%; de alrededor de 3 millones hasta 6.2 millones, impulsado sobre todo por el aumento de la longevidad, por lo que se ha propuesto que para 2040, la cifra excederá los 12 millones de enfermos; incluso más, otros factores como el aumento de subproductos de la industrialización y un descenso en las tasas de tabaquismo (el riesgo de EP disminuye aproximadamente un 40% entre fumadores) podrían elevar el número de individuos afectados a más de 17 millones para 2040.4 En México, la incidencia anual reportada fue de 8.2 en 2014, 10.4 en 2015, 11.4 en 2016, 12.7 en 2017 y 10.8 en 2018 por cada 100,000 habitantes. Los estados que presentaron mayor tasa de incidencia por 100,000 habitantes fueron Sinaloa (27.6), Colima (23.5) y Durango (20), mientras que los estados con menor tasa de incidencia fueron Querétaro (4.6), Zacatecas (3.8) y Guanajuato (3.3). Se ha estimado que para 2023 la incidencia de EP aumentó a 14.9 por 100,000 habitantes en nuestro país.5
La etiología de la EP está asociada a una combinación de factores genéticos y ambientales. Entre estos últimos, además de los desechos de la industrialización, se incluyen deficiencias nutricionales, como falta de consumo de calcio y de antioxidantes, ingesta excesiva de alimentos con elevado índice glucémico, ácidos grasos trans y ácidos grasos saturados.6 También las infecciones, bacterianas (Helicobacter pylori) y virales (virus de la hepatitis C y virus de la influenza), se han asociado con la EP. Una característica común de los virus involucrados es, al parecer, la producción de altas concentraciones de citoquinas y quimiocinas, las cuales logran atravesar la barrera hematoencefálica, lo que condiciona la activación microglial y la inflamación y, en última instancia, la destrucción neuronal.7 La principal evidencia patológica de la EP es la pérdida del área pigmentada del mesencéfalo en la sustancia negra pars compacta y el locus cerúleo, lo cual lleva a la muerte de neuronas dopaminérgicas y de neuronas noradrenérgicas.8 A nivel microscópico, el sello patológico de la EP es la presencia de depósitos citoplasmáticos anormales dentro de los cuerpos celulares neuronales que son inmunorreactivos para la proteína α-sinucleína. Estos agregados proteínicos patológicos se denominan cuerpos de Lewy y suelen ir acompañados de neuritas distróficas, en su mayoría axonales.1 Por otra parte, el tabaquismo y el consumo de cafeína se han asociado con menor riesgo de padecer la EP.9
Aunque la EP suele ser un trastorno complejo y multifactorial, en el 10% al 15% de los casos hay antecedentes familiares, y alrededor de un 5% presenta herencia mendeliana. Se han identificado varios genes implicados en formas raras y heredables de la EP, conocidos como genes PARK, entre los que se incluyen SCNA, LRRK2, VPS32, LRP10, UQCRC1, VPS35, MAPT, GBA, DNAJC13, SCA3, NUS1, ARSA, PSAP y SCA17 de herencia autosómica dominante, y PRKN, PINK1, DJ1, ATP13A2 y FBXO7, de herencia autosómica recesiva.10
Así, el objetivo de este estudio es realizar una revisión sistemática que nos permita conocer los genes y sus variantes que han sido asociadas con la EP en población mexicana.
MATERIAL Y MÉTODOS
Se realizó una búsqueda de artículos a través de la página web de PubMed, publicados en inglés o en español, para estudios de casos y controles que evaluaron asociación de variantes genéticas con la EP en población mexicana. Para la revisión, se utilizaron frases compuestas por las siguientes palabras clave: Genetic polymorphisms, Parkinson, Mexico, Parkinson’s associated genes, SNP, variants, alleles, y single nucleotide polymorphism. Solo se incluyeron variantes bialélicas nucleares, por lo que se descartaron estudios que analizaron mutaciones y variantes del ADN mitocondrial. También se descartaron estudios en los que no fue posible analizar los resultados, así como trabajos de revisión, artículos de asociación de genoma completo (GWAS) y estudios realizados en mexicoamericanos, por ser sujetos expuestos a otras condiciones de vida.
RESULTADOS
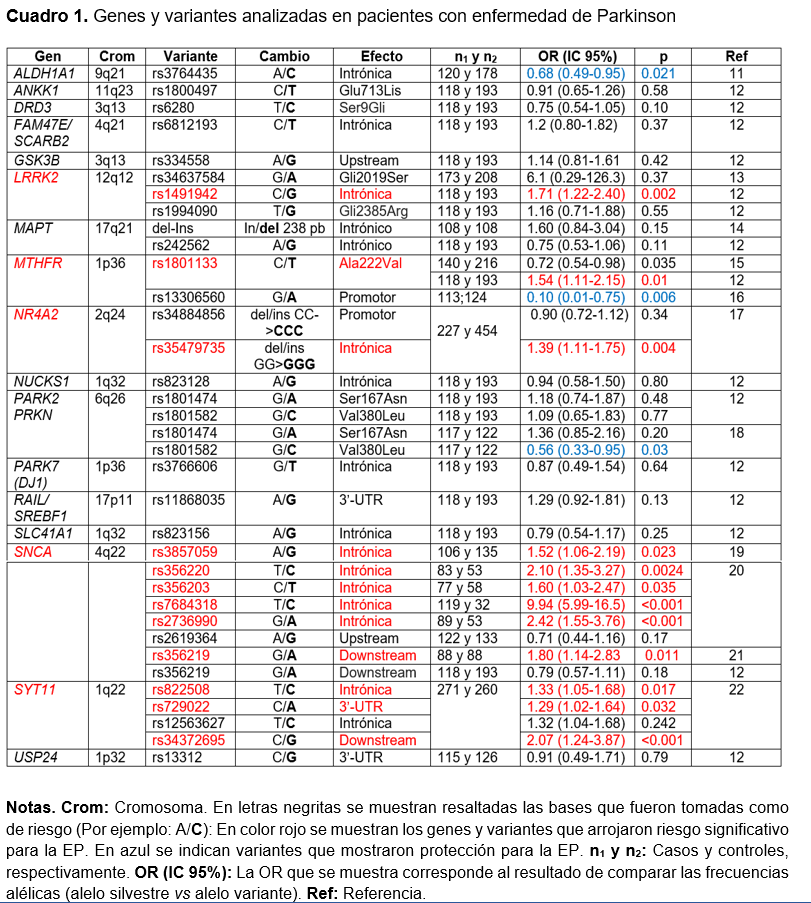
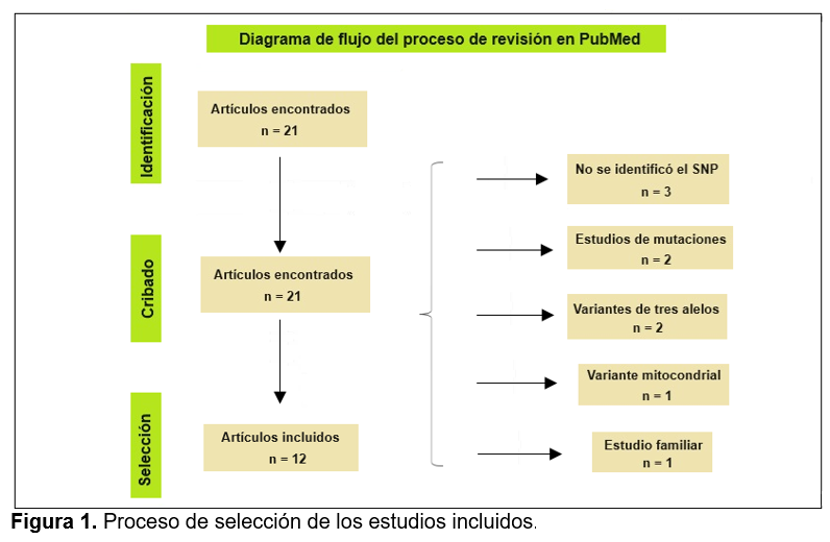
Se encontraron un total de 21 artículos relacionados con nuestro estudio, publicados en un periodo de 18 años (2004-2021); sin embargo, nueve de ellos fueron descartados: tres por no identificar las variantes analizadas, dos por tratarse de variantes trialélicas, dos por analizar mutaciones, uno por analizar variantes mitocondriales y uno por tratarse de un estudio familiar. Así, solo 12 artículos11-22 cumplieron con los criterios de selección (Figura. 1). Entre todos, analizaron 32 variantes, localizadas en 17 genes; de estas, 12 variantes y 5 genes mostraron asociación significativa con la EP. Las variantes asociadas se distribuyeron como sigue: 8/16 sitios intrónicos, 1/4 regiones promotoras o upstream, 1/7 sustituciones de aminoácidos y 2/5 regiones 3′-no traducidas o downstream (Cuadro 1). Entre los genes asociados con la EP se encontraron LRRK2, MTHFR, NR4A2, SNCA y SYT11. Además, tres variantes fueron asociadas con protección para la EP.

DISCUSIÓN
Los estudios de epidemiología genética han mostrado una participación importante de diversos genes involucrados en la función cerebral en la etiología de la EP. En este análisis, cinco genes se encontraron asociados con la EP a través de algunas de sus variantes en población mexicana; dichos genes son LRRK2, NR4A2, MTHFR, SNCA y SYT11. Varios de estos genes ya han sido asociados con la EP en otras poblaciones.10 Sin embargo, los resultados no han sido concluyentes. A continuación, se analizan brevemente cada uno de los genes que se encontraron asociados con la EP en la población mexicana.
LRRK2
El gen LRRK2 codifica la proteína dardarina, la cual tiene actividad de quinasa. Se expresa principalmente en células renales, pulmonares e inmunitarias, y en menor grado en el cerebro, donde su mayor expresión es en el putamen, blanco de las neuronas de la sustancia negra.23 La principal variante del gen LRRK2 es la rs34637584, misma que ocasiona una sustitución Gli2019Ser, la cual otorga mayor actividad de quinasa en comparación con la variante normal. Aunque se desconoce el mecanismo por el cual las mutaciones o variantes del gen LRRK2 aumentan el riesgo de la EP, se sabe que LRRK2 tiene una función reguladora en procesos lisosomales como la mitofagia y autofagia, cuya alteración podría conducir a la acumulación de α-sinucleína, lo cual es fundamental para el desarrollo de la EP.23 En nuestro análisis, la variante rs1491942 se encontró asociada con la EP, lo cual coincide con estudios realizados en población caucásica de Estados Unidos24 [OR=1.37, (1.07-1.75), P=0.013] y en población china25 [OR=1.88, (1.55-2.30), P < 0.001].
MTHFR
El gen MTHFR codifica la enzima metilentetrahidrofolato reductasa, la cual cataliza la conversión del 5,10-metilentetrahidrofolato en 5-metiltetrahidrofolato, un cosustrato para la remetilación de la homocisteína en metionina (https://omim.org/entry/607093). Se ha encontrado que algunas variantes, como la C677T, disminuyen la eficiencia de la enzima, lo que condiciona un aumento de la concentración de homocisteína.26 Concentraciones elevadas de homocisteína aumentan la disfunción mitocondrial, la apoptosis y el estrés oxidativo, además de ser un factor determinante en el proceso fisiopatológico de enfermedades neurodegenerativas, como la EP.27 Así, el alelo 677T de la variante rs1801133 fue asociado con la EP en nuestra población, al igual que en población caucásica [OR=1.18, (1.01-1.37, P=0.040], de acuerdo con un metaanálisis elaborado a partir de 19 estudios realizados en diversas poblaciones alrededor del mundo.28
NR4A2
La proteína NURR1, codificada por el gen NR4A2, es un receptor nuclear que tiene un papel esencial en el desarrollo y mantenimiento de las neuronas dopaminérgicas del mesencéfalo. Durante la génesis de las neuronas dopaminérgicas, NURR1 activa la transcripción del gen de la tirosina hidroxilasa, cuya enzima es muy importante en la síntesis del neurotransmisor dopamina.29 Así, las mutaciones y variantes de NR4A2 que causan una expresión reducida o disfunción de NURR1 han sido vinculadas a la EP familiar y esporádica.30 La variante rs35479735 se encontró asociada con la EP en nuestra población, lo cual es consistente con un metaanálisis realizado a partir de 12 estudios, en los que encontró una asociación significativa [OR=1.31, (1.10-1.56), P=0.003] de dicha variante con la EP.31
SNCA
El gen SNCA codifica la proteína α-sinucleína, la cual se encuentra en la región presináptica del axón. Se cree que su función puede estar relacionada con la transmisión sináptica al regular la liberación y el transporte de dopamina, también induce la fibrilación de la proteína tau asociada a los microtúbulos y ejerce un efecto neuroprotector en las neuronas no dopaminérgicas al inhibir tanto la expresión de p53 como la transactivación de los genes proapoptóticos.32 Las mutaciones sin sentido de este gen anulan el efecto neuroprotector de la α-sinucleína y promueven la apoptosis, al revertir la expresión de p53, lo cual aumenta el riesgo de padecer la EP. Además, la mutación de sentido erróneo, Ala53Tre, se ha asociado a una forma autosómica dominante de la EP.33 En nuestra revisión, seis variantes de SNCA, todos ellos localizados en secuencias intrónicas, se encontraron asociados con la EP. La mayoría de estas variantes ya han sido previamente asociadas con la EP en otras poblaciones, como rs356219,34 en EUA, rs3857059 y rs2736990 en Japón35, así como rs356220,36 rs35620337 y rs768431838 en diversos grupos étnicos. Es posible que algunas de estas variantes alteren la tasa de transcripción del gen en la sustancia negra, y de esta manera aumenten el riesgo para la EP.37-39
SYT11
El gen SYT11, que se expresa abundantemente en todo el cerebro, codifica para la sinaptotagmina-11 (Syt11), la cual se ha sugerido que desempeña un papel importante en la sustancia negra pars compacta como mediador de neurotoxicidad. Interactúa con Parkin y regula los grupos de vesículas dopaminérgicas al inhibir la endocitosis dependiente de dopamina, limitando así la invaginación de la membrana en el ganglio de la raíz dorsal y las neuronas del hipocampo.40,41 También, se ha propuesto que Syt11 inhibe la secreción de citoquinas y la fagocitosis en las células gliales, pero su función precisa en el desarrollo y el funcionamiento de los circuitos neuronales sigue siendo en gran parte desconocida.40 En nuestro análisis, las variantes rs822508, rs729022 y rs34372695 se encontraron asociadas con la EP. De ellas, las variantes rs729022 y rs34372695 ya habían sido relacionadas con la EP; la primera, en población gallega22, y la segunda, en diversos grupos étnicos.42 Se desconoce el efecto que podrían tener estas variantes en la expresión del gen, ya que ambas se encuentran en regiones no codificantes.
CONCLUSIONES
Esta investigación nos permitió conocer que la EP en población mexicana está relacionada con diversas variantes genéticas, especialmente de un solo nucleótido, mismas que ya han sido ligadas con la enfermedad en otras poblaciones. En nuestra revisión, el 37.5% de las variantes y el 29.4% de los genes analizados se encontraron asociados con la EP, lo cual muestra la amplia heterogeneidad genética que presenta la enfermedad. Se sabe que es importante conocer y comprender la fisiopatogenia de cualquier trastorno, y la EP no es la excepción, ya que de esta manera sería posible implementar estrategias de prevención o, incluso, de tratamientos más personalizados que conduzcan a mejores resultados terapéuticos en beneficio de los pacientes que sufren esta enfermedad.
Referencias