Rev Med UAS
Vol. 13: No. 4. Octubre-Diciembre 2023
ISSN 2007-8013
Francisco Josué Fernández-Becerra1, Lizbeth Miranda-García2, Paulina Briseño-Sahagun3,* .
*Autor de correspondencia: Paulina Briseño Sahagun.
Facultad de Medicina Mexicali. Universidad Autónoma de Baja California.
Dr. Humberto Torres Sanginés S/N, Centro Cívico, 21000. Mexicali, Baja California, México.
Phone: +52 686 557-1622 ext. 45362. E-mail: paulina.briseo@uabc.edu.mx
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v13.n4.011
Texto Completo PDFRecibido 24 de enero 2023, aceptado 29 de abril 2023
RESUMEN
El nacimiento prematuro hoy en día sigue siendo un problema frecuente en los hospitales por el mayor riesgo de morbi-mortalidad ante la inmadurez de órganos y sistemas. Estos niños están expuestos a agravantes ambientales que pueden afectar su crecimiento y desarrollo. La microbiota participa tanto directa como indirectamente en la maduración y protección del sistema nervioso central. Mientras más factores adversos se encuentren presentes en los primeros 1000 días de vida, se podría comprometer el establecimiento y maduración de una microbiota sana (eubiosis). Cuando ocurre una alteración (disbiosis) se ha observado una correlación importante con diversos trastornos neurológicos. Esta revisión se enfoca en los factores que precipitan estas alteraciones, los mecanismos que podrían explicar el mayor riesgo neurológico y las principales patologías asociadas en la infancia, para poder ofrecer acciones de prevención y tratamiento oportuno.
Palabras clave: recién nacido prematuro, microbiota, eje cerebro-intestino, trastornos del neurodesarrollo.
ABSTRACT
Premature birth continues to be a common problem in hospitals because of the increased risk of morbidity and mortality due to the immaturity of organs and systems. These children are exposed to environmental aggravations that can affect their growth and development. The microbiota participates both directly and indirectly in the maturation and protection of the central nervous system. The more adverse factors that are present in the first 1000 days of life, the more the establishment and maturation of the health microbiota (eubiosis) may be compromised. When an alteration (dysbiosis) occurs, a significant correlation with various neurological disorders has been observed. This review focuses on the factors that precipitate these alterations, the mechanisms that could be explain an increased neurological risk, and the main associated pathologies in infancy, to offer preventive action and opportune treatment.
Keywords: Infant, Premature, Microbiota, Brain-Gut Axis, Neurodevelopmental Disorders.
INTRODUCCION
En los últimos años ha incrementado el interés por la investigación de la microbiota y su impacto en el organismo, incluso su implicación desde el nacimiento, tanto en productos nacidos a término como en aquellos prematuros 1. Así como un análisis de aquellos factores que se ven involucrados en alteraciones en la composición de su microbiota y el impacto que genera en su desarrollo neurológico 2.
Durante el parto ocurre la primera exposición directa con microorganismos a través del canal vaginal, los cuales se encuentran presentes colonizando diversas estructuras del cuerpo humano, como piel, mucosas, cavidades, etc.2. Millones de estos microorganismos que adquiere el recién nacido se encuentran a nivel gastrointestinal, participando en el eje microbiota-intestino-cerebro, con importantes efectos en el desarrollo neurológico, donde las principales categorías encontradas son firmicutes, bacteroidetes, proteobacterias, actinomycetes, verrucomicrobia y fusobacterias, mostrando gran predominancia los 2 primeros 3.
Esta red compleja de microorganismos tiene la capacidad de actuar como un órgano con gran actividad metabólica, ya que cuentan con la capacidad de metabolizar polisacáridos y otros carbohidratos más complejos en ácidos grasos de cadena corta (AGCC), como ejemplos de ellos lo son el butirato, el cual es usado como fuente de energía por los colonocitos, mientras que el propionato y acetato, son requeridos en el hígado para llevar a cabo lipogénesis y gluconeogénesis 4.
La microbiota se compone de alrededor de 1000 diferentes especies de bacterias, las cuales son capaces de codificar más de 3 millones de genes, con la capacidad de generar miles de metabolitos con diferentes funciones en el organismo del recién nacido 5. Los recién nacidos prematuros presentan muchas alteraciones en su microbiota debido a diversos factores, incluyendo infecciones perinatales, método de parto, requerimiento y duración en una unidad de cuidados intensivos, alimentación con leche materna o complementaria, exposición temprana a antibióticos, entre otros 6.
La microbiota del recién nacido a término alcanza su madurez y comparte similitud a la de los lactantes a los 12-36 meses de edad 7. Por lo cual este periodo, conocido como los primeros 1000 días, es crítico para un abordaje oportuno, evitar las condiciones que favorezcan las diversas enfermedades que puedan presentarse 8.
Está bien establecido que el desarrollo neurológico que comprende principalmente la neurogénesis, sinapsis y mielinización, comienza alrededor de la semana 20 de gestación, por lo cual la prematuridad es un gran desencadenante de diversos trastornos neurológicos a causa de un desarrollo deficiente 9. Si, además, su crecimiento posnatal no es el adecuado y su entorno para el desarrollo no es el favorable, se agregaría otro factor importante que repercute en el proceso de maduración de la microbiota 10. En esta revisión abordaremos la diferencia que presentan en la composición de la microbiota un bebé prematuro a uno de término, así como los cambios en el proceso de maduración que influyen en alcanzar las características encontradas a una edad corregida de término 11.
Establecimiento de la microbiota inicial
Diversos estudios han demostrado que existen diferencias significativas en la microbiota de recién nacidos de término y prematuros, además de que la mayoría de estos recién nacidos prematuros se ve enfrentados a muchas adversidades que generar alteraciones en su microbiota, como lo son el método de entrega, ya sea cesárea o parto vaginal, el uso o no de ventilación mecánica invasiva, la administración de antibióticos, etc. 1.
En los recién nacidos de término nacidos por vía vaginal y alimentados a través del seno materno se sigue un patrón de maduración de microbiota generalizado, caracterizado con una colonización inicial con predominancia de anaerobios facultativos, los cuales incluyen enterobacterias (E. Coli, Klebsiella spp,), Estreptococos spp, Estafilococos spp 12. Esta microbiota es sustituida alrededor de la sexta semana de vida a causa del pronto agotamiento de oxígeno y el inicio de la lactancia materna rica en oligosacáridos por anaerobios obligados, como lo son Bacteroides spp, Bifidobacterias spp, Clostridium spp 10, 12. Con la implementación de la dieta complementaria después de los 6 meses de vida se reduce la población de bifidobacterias spp en un 30-40%, lo cual va a persistir durante la niñez y la adolescencia, sujeta a cambios por el estilo de vida, alimentación y uso de antibióticos 12.
En ocasiones la composición inicial de la microbiota entre un recién nacido prematuro y uno de término puede no variar de manera significativa, pero pueden existir diferencias en la sucesión o desarrollo de la microbiota 13. Los bebés prematuros cuentan con sucesión retardada a Bifidobacterias, ya que cuentan con un dominio extendido de enterobacterias posterior a los 90 días de vida, alcanzando similitudes en los tres principales filos (firmicutes, proteobacterias y actinobacterias) como en uno de término hasta los 120 días de vida 11. Sin embargo, se observó que la abundancia difería incluso hasta el año de edad, sin tener en cuenta factores externos como alimentación, hospitalizaciones, antibióticos, etc. 11.
Existen otros factores ambientales que influyen en cierto grado a la colonización inicial y la sucesión de la microbiota, el primero sería la vía del nacimiento 14. En los recién nacidos por vía vaginal, se observa una mayor cantidad de lactobacilos, prevotella, bifidobacterias, bacteroides mientras que los recién nacidos por cesárea cuenta con mayores especies microbianas oportunistas que se encuentran en el entorno hospitalario y en la piel de la madre, como lo son Clostridium spp, Staphylococcus spp, Streptococcus spp, Enterobacteriaceae, Klebsiella spp 1,15. Por otro lado, durante el primer año de vida, aquellos que nacieron por vía vaginal contaban con microbiota más estable que aquellos nacidos por cesárea, lo que sugiere que las especies que se adquieren en dicho entorno no pueden adaptarse al intestino del recién nacido 16.
La alimentación inicial es otro factor de impacto en el establecimiento y maduración de la microbiota 14. En los bebés de término que reciben alimentación a través del seno materno de forma exclusiva se encontró que cuentan con más taxones de clase protectora Actinobacteria y proteobacterias, mientras que aquellos que eran alimentados con fórmula cuentan con niveles más altos de Firmicutes y bacteroidetes 17. Aunado a ello, se ha encontrado que la microbiota en los alimentados con leche materna muestra mayor estabilidad y más interacción con el genoma del recién nacido, produciendo una mayor respuesta inmunitaria y metabólica 17,18.
Las condiciones del periodo perinatal inmediato comprenden otros factores implicados en alteración de la microbiota 17. La exposición a antibióticos, dependiendo el momento, tiempo y tipo de exposición, mediante la profilaxis intraparto en recién nacidos de termino y prematuros, demostró en esos casos una reducida cantidad de lactobacilos y bifidobacterias, principalmente en los que fueron tratados con meropenem, cefotaxima y ticarcilina clavulanato 9. Esto a su vez produce un incremento en especies patógenas como Kebsiella pneumoniae, Escherichia Coli (E. Coli) y Enterobacter Cloacae, con mayor número de genes que generan resistencia a los antibióticos en comparación a los microorganismos comensales, volviéndose más susceptible a un mayor número de infecciones oportunistas 9.
Dentro de los factores ambientales que se han encontrado, se observó que en recién nacidos que cuentan con hermanos mayores al nacer, cuentan con mayor abundancia de bifidobacterias y menor cantidad de anaerobios en relación con los que no cuentan con hermanos 14,19.
Otros estudios han demostrado que un entorno rodeado de animales en los recién nacidos genera cambios en la misma 16. Se observó en lactantes menores de 4 meses que viven rodeados de mascotas (gatos) una microbiota enriquecida en Peptostreptococcaceae y una menor población de bifidobacterias, a diferencia de los que vivían sin mascotas 16.
Mecanismo de comunicación en el Eje Microbiota-intestino-cerebro
Se denomina eje microbiota-intestinal-cerebro a la comunicación bidireccional que ocurren entre el sistema nervioso central y el sistema nervioso entérico, dicha interacción entre ambas partes logra llevarse a cabo gracias diverses tipo de señalizaciones por redes neuronales complejas, mediadores metabólicos e inmunológicos 20,21.
Durante el periodo prenatal el vago establece conexión con el intestino, ya que le proporciona inervación desde duodeno en su porción proximal hasta colon descendente distal 2. En el ganglio nodoso encontramos neuronas sensoriales primarias de las cuales salen proyecciones a la pared intestinal y otra al núcleo del tracto solitario (NTS) presente en el rombencéfalo 2. Estas últimas recaen en diversas áreas del cerebro anterior, como lo es el núcleo paraventricular del hipotálamo (PVN) y el núcleo arqueado, los cuales van a estar enviando señales ante diversas situaciones intestinales como alteraciones del contenido químico, distensión e inflamación 2.
La microbiota en el organismo siempre se encuentra de forma dinámica, cambiante y en su mayoría del tiempo equilibrada, cumpliendo con grandes funciones y con mucho impacto en el sistema inmunológico intestinal y el desarrollo neurológico 22. La microbiota más estudiada es la presente en el tracto gastrointestinal, desde su cavidad oral hasta recto, la cual, a través de la producción de diversos metabolitos, conforman el microbioma intestinal de nuestro organismo 2. El microbioma lleva a cabo una comunicación bidireccional con el cerebro principalmente a través del sistema nervioso entérico y autónomo, así como con el sistema endocrino e inmunológico 23.
Gran parte de los metabolitos producidos por la microbiota local actúan en receptores del nervio vago de la vía aferente, siendo este el principal mecanismo en la transmisión de señales entre microbiota-intestino-cerebro 2. Estas vías otorgan inervación a la mucosa intestinal principalmente por medio de metabolitos producidos por la microbiota como lo son los ácidos grasos de cadena larga, como el oleato y de cadena corta como el butirato 24.
También estos ácidos grasos tienen importante participación en la biosíntesis de 5-hidroxitriptamina (5-HT), la cual se conoce como serotonina, considerada como punto clave en la comunicación entre cerebro e intestino 5. Las principales fuentes productoras de serotonina son las células enteroendocrinas (EEC) y las neuronas serotoninérgicas, la producida en las primeras favorece una reacción proinflamatoria en el sistema nervioso entérico (ENS), a diferencia de la proveniente de las neuronas serotoninérgicas, la cual su principal función es favorecer la neuro protección 25.
En estudios en ratones libres de gérmenes, al proveerlos de microbiota específica, se encontró que hay una disminución en los niveles de serotonina en suero, porque se ve afectado el metabolismo del triptófano por medio de la vía de quinurenina, la cual es mediada por enzimas inflamatorias como lo es la indoleamina-2,3-dioxigenasa (IDO1) 25.
Otra vía implicada en la formación de serotonina es mediante una transformación directa del triptófano en una moléculas que incluyen el receptor de aril de hidrocarburos (AhR) mediado por la microbiota intestinal 26. Un ejemplo de ello es gracias a E. Coli, la cual puede metabolizar triptófano y producir indoles para favorecer la activación de astrocitos y modular la inflamación a nivel cerebral mediante la activación de los AhR 27.
Por lo cual se ha encontrado que los AhR actúan como sensor para mantener una homeostasis entre las células intestinales y las células inmunes, y las neuronas entéricas 26. En estudios en ratones tratados con antibióticos se observó que gracias a este tipo de expresión de receptores se mejoraba la motilidad intestinal 26.
Otra vía de comunicación es en situaciones de estrés, en el cual se aumenta la permeabilidad intestinal, lo que conlleva a un mayor desplazamiento de agentes microbianos y antígenos a la mucosa intestinal 24. Esto producirá una activación inmune y liberación de citocinas proinflamatorias, activando el eje hipotálamo-hipófisis-suprarrenal (HPA) 25. En diversos estudios in vitro se observó que tras el estímulo con diversas citocinas proinflamatorias se ve afectada la integridad de la barrera intestinal, conllevando a una mayor translocación bacteriana 25. La microbiota tiene un papel en esta permeabilidad, como lo han demostrado estudios en ratas que sufrieron estrés agudo y se evidenció disminución de la permeabilidad colónica tras la administración de probióticos 24
Microbiota con mejor perfil neurológico
En los recién nacidos el neurodesarrollo progresa de manera conjunta con el desarrollo de la microbiota, por lo cual una alteración en esta puede producir diferencias en la fabricación de metabolitos participantes en la comunicación del eje intestino-cerebro, sistema inmunológico e inflamación del sistema nervioso central (SNC), así como en el mantenimiento de la integridad del barrera hematoencefálica 10.
En muchos estudios se ha evidenciado que la microbiota de un bebé prematuro difiere a la de uno de término, no sólo en el filo bacteriano, sino principalmente por la baja diversidad y alta variación interindividual, por lo cual es considerado como el principal factor implicado en alteraciones del desarrollo neurológico en bebés prematuros, incluyendo leucomalacia periventricular, parálisis cerebral, trastornos por déficit de atención, entre otros 9.
En estudios de cohorte se han observado que los pacientes que presentaban una colonización con mayor abundancia de bacteroides (bacteroidetes), presentaban un desarrollo neurológico más favorable, con mejores puntuaciones en lenguaje y cognición 28. Este grupo de bacterias tienen gran impacto en el neurodesarrollo de la infancia tardía, observando su efecto a través de la producción, degradación y metabolitos provenientes de los AGCC, que contribuyen en la mielinización y conectividad neuronal compleja del sistema nervioso, volviéndose más óptimos para un mejor desarrollo neurológico 28.
El crecimiento posnatal también influye en el desarrollo neurológico 10. En estudios con 2 grupos de ratones libres de gérmenes, a un grupo se le trasplantó materia fecal de prematuros con un pobre crecimiento en una unidad de cuidados intensivos y al segundo grupo se le trasplantó materia fecal de prematuros con un adecuado crecimiento 10. En el primer grupo en comparación al segundo se observó retraso en el neurodesarrollo, en la diferenciación de oligodendrocitos, así como en la mielinización, además de una predisposición a neuroinflamación, alteraciones en las vías de neurotransmisión y disminución de los niveles de factor de crecimiento similar a la insulina I 10. Viendo este último implicado en muchos efectos adversos como lo son crecimiento deficiente, microcefalia y deterioro cognitivo grave 29.
Metabolitos de la microbiota con efecto a nivel neurológico
La microbiota del intestino cumple con diversas funciones, dentro de las cuales las principales son metabolizar nutrientes y la síntesis de diversas vitaminas generando gran cantidad de metabolitos y moléculas con diferentes funciones en el organismo 30. Se han estudiado diversos de estos metabolitos producidos con impacto en el desarrollo neurológico 31. Uno de los principales son los oligosacáridos, gran parte de ellos son obtenidos de la leche de la madre y no son digeribles, por lo cual las bacterias contenidas en los intestinos cumplen la función de fermentación 32. Este proceso metabólico produce como resultado AGCC, siendo los principales y más abundantes acetato, propionato y butirato 22.
Firmicutes es la principal productora de butirato el cual es metabolizado en la mucosa epitelial y contribuye a la conservación de la salud intestinal, mientras que los bacteroides fabrican propionato y acetato 32. Estos metabolitos tienen influencia en el sistema inmunitario, a través de su unión a receptores acoplados a proteína G, los cuales incluyen los receptores de ácidos grasos libres 2 y 3 33. Estos receptores estimulan a las células dendríticas locales del intestino, así como impulsan su desarrollo, diferenciación y que puedan recuperarse de manera óptima 33.
Una vez que estos ácidos se unen a receptores acoplados a proteínas G se produce mayores cantidades de péptido YY (PYY) y glucagón 1 (GLP1) por parte de las células enteroendocrinas, el GLP1 en estudios en roedores ha demostrado tener participación en la memoria y aprendizaje, así como en una mejor plasticidad neuronal y neuroprotección del hipocampo 34. Con respecto al PYY secretado por las células L del sistema gastrointestinal, así como por la hipófisis y el hipotálamo se observó que tiene influencia en el apetito, así como en la actividad cerebral por medio de aferencias vágales que conectan intestino y cerebro 34.
Los AGCC, principalmente el butirato, participa en el mantenimiento de la integridad de la barrera epitelial a través de la regulación de proteínas como la ocludina, claudina-1, entre otras, por lo cual al existir una disminución de estos metabolitos va a ocurrir una mayor translocación bacteriana y de lipopolisacáridos, favoreciendo un estado proinflamatorio 32,35. Estudios en ratones libres de gérmenes demostraron que con la colonización con cepas productoras de AGCC y con la administración de butirato de sodio se logra aumentar la expresión de este tipo de proteínas, mejorando la integridad de la barrera 9. Otro estudio mostró que la administración de butirato vía oral en ratones tratados con antibióticos en los que se produjo un desequilibrio en la microbiota intestinal y con ello una alteraciones en la mielinización caracterizada por desórdenes de comportamiento, se obtuvo una mejoría tras la administración de estos AGCC 36.
La microbiota intestinal regula la inmunidad neuronal, produciendo su impacto a través de los PAMP (patrones moleculares asociados a patógenos) derivados de la misma, activando diversas funciones inmunológicas a nivel sistémico 7. Estas moléculas, como lo son los polisacáridos (LPS), lipoproteínas, ácido desoxirribonucleico (ARN), proveniente de patógenos oportunistas activan el sistema inmunológico 29.
Los PAMP una vez que se unen a los receptores TLR de las células inmunológicas produciendo una activación de transductores de señales que posteriormente genera una mayor activación de factores de transcripción como el Nf-KB los cual genera una mayor secreción de mediadores inflamatorios, aumentando la inflamación 37. Lo cual suele causar daño a nivel cerebral como leucomalacia periventricular y encefalopatía hipóxico-isquémica, encontrándose en múltiples trastornos neurológicos como lo son el autismo, parálisis cerebral, esquizofrenia, entre otros 29.
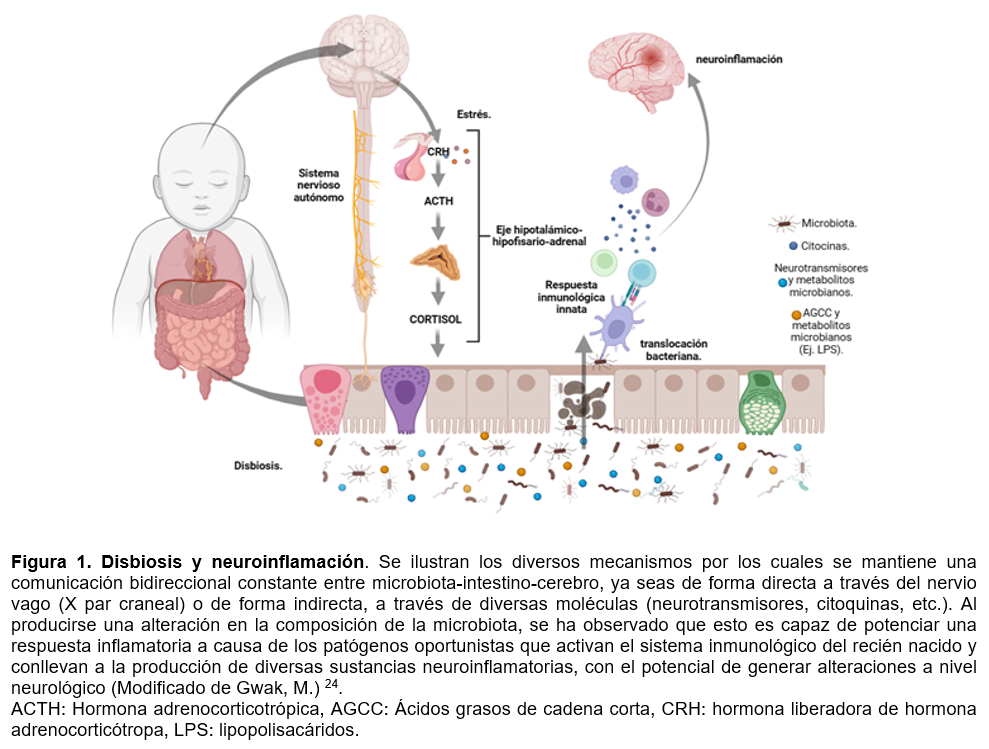
Diversos estudios en modelos animales han demostrado que los procesos infecciosos asociados a la disbiosis intestinal durante los primeros días de vida generan neuroinflamación cerebral, predominantemente por generación de citocinas proinflamatorias, dentro de las cuales destacan la interleucina 1B (IL-1B), factor de necrosis tumoral (TNF) e Interleucina-6 (IL-6), entre otras 9,38. (Ver Figura 1). En dichos estudios se encontró que estos presentaban daños en la materia blanca producto de una deficiente mielinización y activación de la microglía 9.
Se ha encontrado que los AGCC tienen un impacto directo sobre el sistema inmunológico de forma favorable, mediante la regulación de la inflamación. Dichos metabolitos regulan la maduración y activación de linfocitos T, macrófagos, células dendríticas y neutrófilos 32. Estos últimos teniendo gran relevancia, ya que son los primeros en aparecer en el sitio de inflamación, donde los AGCC logran favorecer una respuesta antiinflamatoria por medio de la inhibición de la histona desacetilasa (HDAC), lo cual reduce la producción de TNF e IL-6, importantes citocinas proinflamatorias 32.
En estudios en roedores con disminución en la cantidad de Lactobacilos y Bifidobacterias se encontró un incremento en la producción de la IL-1B, la cual suprime al factor neurotrópico derivado del cerebro, afectando de forma específica la amígdala, la cual tiene gran participación en el proceso de la memoria y las emociones 33.
Las células del sistema inmunológico ejercen influencia en los astrocitos y a través de las citocinas que producen 39. Durante el desarrollo, la microglía favorece la transmisión sináptica, así como la poda sináptica, creando un circuito neuronal 7. Por su parte los astrocitos forman parte importante del sistema nervioso central, manteniendo una función adecuada de la barrera hematoencefálica, así como en la transmisión de los nutrientes celulares 7. En diversos estudios en animales, se ha encontrado afectación en ambas estirpes celulares, causando alteraciones en el desarrollo neurológico 7.
Estudios realizados recientemente han encontrado relación directa entre la microbiota y la microglía, tanto en su desarrollo, así como en su maduración 36. En ratones libres de gérmenes se observó que estas células del sistema nervioso mostraron alteración en su desarrollo, con una respuesta deficiente ante infecciones virales o PAMP microbianos, mostrando mejoría con la administración inmediata de AGCC 36.
Anormalidades en la composición de la Microbiota intestinal en determinadas Enfermedades del Sistema Nervioso
Como se ha explicado, existen diversos mecanismos por los cuales se da una comunicación e interacción continua entre intestino y cerebro, por lo cual una alteración a nivel intestinal ha demostrado correlación con diversas enfermedades a nivel neurológico a causa de una respuesta inflamatoria 40. Un claro ejemplo de ello es la esclerosis múltiple, enfermedad de Parkinson, Alzheimer y trastorno del espectro autista 40.
Debido al interés en aumento que ha tenido en los últimos años la relación intestino-cerebro, algunos artículos se han comenzado a cuestionar el papel que podría jugar los cambios en el microbioma en el aspecto de enfermedades y trastornos que afectan el cerebro como lo son: Trastorno del espectro autista (TEA), Trastorno déficit de atención e hiperactividad (TDAH), Epilepsia, entre otros 3,40,41.
El TEA ha sido uno de los más estudiados en este campo, se ha logrado apreciar en estudios realizados con ratones en los cuales, al trasplantar microbiota de individuos con TEA en ratones libres de gérmenes, estos adquirían el comportamiento característico de este tipo de trastornos 7,23. Otro hallazgo importante ha sido que individuos que presentan sintomatología de TEA se encontraban con patrones anormales en los niveles de Clostridios, Desulfovibrio, Bifidobacteria y Bacteroides 5,41, incluso se notó que, en comparación con individuos neurotípicos, el grupo con TEA mostró una abundancia significativamente mayor de Clostridium 23. A su vez estos síntomas referentes a comportamientos sociales en la infancia se han asociado con las alteraciones de los niveles de bacterias desde las 6 semanas de vida 7.
En el caso de TDAH se observó una correlación significativa entre los niveles de hiperactividad y cambios en la diversidad alfa de las bacterias, así como niveles más altos de Neisseriaceae 3. Mientras que, en individuos con Epilepsia, se ha encontrado que la microbiota de los pacientes con cuatro crisis o menos al año presentaron un aumento de Bifidobacterium y Lactobacillus en comparación con aquellos que presentaban más de cuatro crisis al año 41. Si bien, estudios demuestran una posible influencia de la microbiota en estos padecimientos, la mayoría de estos estudios presentaron limitaciones metodológicas que afectan sus resultados 3,41.
Conclusión
La microbiota juega un papel muy importante en el desarrollo y la prevención de muchas enfermedades del recién nacido, al mantener una comunicación que permite regular funciones intestinales y neuronales, desde el nacimiento hasta los primeros 3 años de vida. Se ha demostrado que la sucesión de esta microbiota debe seguir un camino específico que puede alterarse (disbiosis) por prematurez y/o exposición a factores externos. Algunos de ellos son el modo de nacimiento, el uso de antibióticos, el tipo de alimentación, entre otros, que pueden deteriorar aún más el desarrollo neurológico de los niños y niñas con antecedente de prematuridad. Estos cambios conllevan al mayor riesgo de producción de sustancias inflamatorias, que producen alteraciones a nivel de SNC observados en diversos trastornos neurológicos. Muchas de estas alteraciones pueden mejorarse con la implementación de cambios oportunos en el recién nacido, con la finalidad de mejorar la composición de la microbiota en los primeros años de vida, mantener una eubiosis y disminuir el riesgo de patologías neurológicas

Referencias