Rev Med UAS
Vol. 13: No. 4. Octubre-Diciembre 2023
ISSN 2007-8013
Maradí Zumara Rubio-Rodríguez1, Víctor Fernando Muñoz-Estrada1, Rosal Anais Valenzuela-Marrufo2,*
Hospital Civil de Culiacán
*Autor de correspondencia: : Dra. Rosal Anaís Valenzuela-Marrufo
Departamento de Dermatología y Micología del Centro de Investigación y Docencia en Ciencias de la Salud,
Hospital Civil de Culiacán, UAS.
Eustaquio Buelna #91, Col. Gabriel Leyva. CP 80030.Culiacán, Sinaloa.
E-mail: rosal.mv93@gmail.com
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v13.n4.012
Texto Completo PDFRecibido 06 de agosto 2023, aceptado 22 de noviembre 2023
RESUMEN
El dermatofibrosarcoma protuberans (DFSP) es un sarcoma cutáneo derivado de los fibroblastos. Es más frecuente en hombres entre la tercera y cuarta decada de la vida. Este tumor se puede presentar como una placa o un nódulo color rosado que semeja una cicatriz. El diagnóstico se basa en la exploración física y se confirma con el estudio histopatológico e inmunohistoquímica. El tratamiento de elección es quirúrgico con margenes amplios libres de lesión; Sin embargo, se puede optar por radioterapia o inhibidor multicinasa como el imatinib. El pronóstico depende de la edad avanzada del paciente, la recurrencia de la enfermedad, su topografía y el tipo histológico
Palabras clave: Dermatofibrosarcoma protuberans, sarcoma, cirugía micrográfica de Mohs.
ABSTRACT
Dermatofibrosarcoma protuberans (DFSP) is a cutaneous sarcoma derived from fibroblasts. It is more frequent in men between the third and fourth decade of life. This tumor may present as a pink plaque or nodule that resembles a scar. The diagnosis is based on physical examination and is confirmed by histopathological and immunohistochemical study. The treatment of choice is surgery with wide lesion-free margins; However, radiotherapy or a multikinase inhibitor such as imatinib can be chosen. The prognosis depends on the advanced age of the patient, the recurrence of the disease, its topography and the histological type.
Keywords: Dermatofibrosarcoma protuberans, sarcoma, Mohs micrographic surgery
INTRODUCCION
El dermatofibrosarcoma protuberans (DFSP) es un tumor cutáneo superficial clasificado como un sarcoma maligno derivado de los fibroblastos dérmicos, que clinicamente se caracteriza por ser un tumor de crecimiento lento, de grado bajo a intermedio, con una alta tasa de recurrencia local, pero con bajo riesgo de metastasis.1
Clínicamente suele presentarse como una placa o nódulo asintomáticos de color rosado o púrpura. Este tumor se caracteriza por estar formado de células fusiformes con presencia de procesos celulares largos y delgados que se ramifican similarmente a las células dendríticas, dando un patrón estorifome.1
El tratamiento convencional en los tumores resecables es la escisión quirúrgica completa con margenes amplios libres de lesión tumoral, cirugía de micrográfica de Mohs o en algunos casos la amputación. En casos de tumores irresecables se opta por la radioterapia. Todas las opciones de tratamiento tienen sus indicaciones, ventajas y desventajas por lo que en esta revisión discutimos cada una de ellas.
Epidemiología
El DFSP es un sarcoma de tejidos blandos poco común. Representa < 0.1% de todas las neoplasias malignas y < 1% de todos los sarcomas de tejidos blandos.2 Siendo el segundo sarcoma más común después del Sarcoma de Kaposi.3
La incidencia anual reportada en los Estados Unidos es de 0.8 a 4.1 casos por cada millón de personas.4
En general, se ha reportado mayor incidencia en hombres;5 Sin embargo en México se reporta mayor frecuencia en mujeres, entre los 16- 85 años con una edad media de los 36 años, siendo el subtipo clásico de DFSP el más común en nuestra población.6
Patogénesis
Se ha observado en el 90% de los DFSP la traslocación t(17;22)q(22;q13). Generalmente esto da lugar a la formación de cromosomas en anillo que se derivan del cromosoma 22 y contienen secuencias amplificadas de 17q22 y 22q10. De menor forma puede derivarse una forma lineal del cromosoma 22.
Estas traslocaciones contienen un gen de fusión en el que el polipéptido beta del factor de crecimiento derivado de las plaquetas (PDGFB) se fusiona con el gen de colágeno tipo 1A1, creando a la proteina PDGFB/COL1A1 que activa continuamente al receptor β del PDGFB, siendo este paso fundamental para el desarrollo del tumor.7
Clínica
El DFSP puede afectar a cualquier segmento, sin embargo el tronco es el lugar más frecuente en un 42% de los casos, seguido de extremidades superiores e inferiores en un 21% respectivamente, cabeza y cuello 13% y genitales en 1 %.4
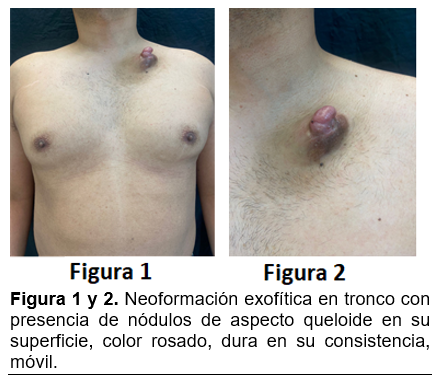
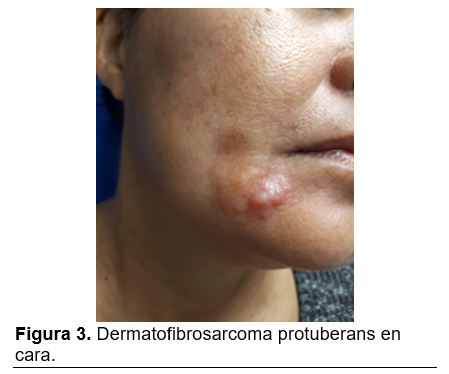
Clínicamente inicia como una placa del color de la piel normal a rosada, asintomática. Presenta un crecimiento muy lento, pudiendo adquirir aspecto morfeiforme, atrofodermia o similar a angioma. Conforme a su desarrollo e infiltración, pasa de la fase de placa a la fase de tumor con la aparición de nódulos en su superficie, variando el tamaño de la lesión de acuerdo al tiempo de evolución. (Figura 1-4)
Este tumor suele localizarse en la dermis e infiltrar al tejido celular subcutáneo, por lo que a la exploración resulta móvil y no adherido a planos profundos en los casos no invasores.8 Las lesiones de larga evolución o recidivantes pueden infiltrar a la fascia, músculo, periostio o hueso.9

Diagnóstico
Histopatología
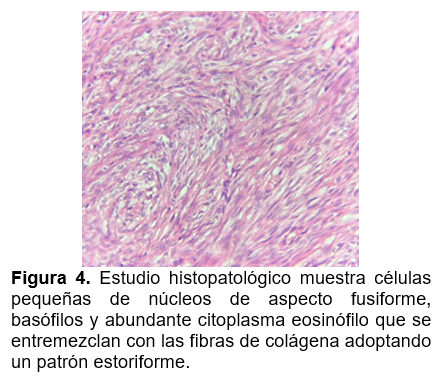
El tumor se localiza en la dermis, está conformado por una proliferación de células fusiformes, de núcleo grande, elongados con baja actividad mitótica. Estas células se disponen en fascículos entrelazados irregularmente, generando un patrón estoriforme. Presenta un estroma escaso, con depósito de colágeno intercelular.La celularidad suele ser mayor en el centro que en la zona perférica del tumor, que suele infiltrar hacia dermis circundante y tejido subcutáneo en forma de tentáculos a través de septos y lobulillos, pudiendo generar infiltración a una distancia considerable del foco central de la lesión.9 El perfil de inmunohistoquímica del DFSP es CD34 positivo, vimentina positivo, nestina positivo, factor XIIIa negativo y S100 negativo . EL CD34 es el marcador más sensible (84% al 100%) y específico (83%).9
Imagen
Los estudios de imagen no se solicitan de manera rutinaria debido a la localización superficial del tumor. Sin embargo, se puede solicitar en casos de lesiones extensas, atípicas o tumores recurrentes.10
La resonancia magnética es un estudio de imagen útil para evaluar los tumores de tejidos blandos, y supera a la palpación física en la detección de la profundidad e infiltración del DFSP. Aunque el mejor estudio para la evaluación de la infiltración y extensión lateral es el estudio histopatológico, la RM con contraste se puede utilizar durante la valoración prequirúrgica en casos localizados en cabeza, cuello, parte superior del tórax y en casos que se sospeche invasión profunda. 11,12
Por otra parte, en caso de sospecha de recurrencia y metástasis, la ecografía de ganglios linfáticos, tomografía y resonancia magnética son útiles. 13
Tratamiento
La piedra angular en el tratamiento es la escisión quirúrgica con márgenes libres de lesión. Aún es controvertido el tamaño del margen para evitar las recurrencias. En la mayoría de las ocasiones se prefieren margenes amplios, sin embargo puede no ser factible en los casos en los que se comprometan algunas zonas anatómicas desafiantes como cabeza y cuello, en las que se prefiere la cirugía micrográfica de Mohs para la máxima preservación del tejido sano.
Cirugía convencional
La escisión quirúrgica sigue siendo el tratamiento de elección. Sin embargo aun no hay consenso sobre los márgenes de seguridad estandarizados en una escisión amplia.
Esto se logra mediante una escisión tridimencional, incluyendo la piel normal, tejido subcutáneo y fascia subyacente tomando los márgenes desde el límite del tumor macroscópico.2
Akram et al. encontraron una tasa de recurrencia local después de la escisión estrecha del 60%, por el contrario de 7.3% en los casos de margenes amplios.14
Las directrices de la Red Nacional Integral del Cancer (NCCN) sugieren un margen entre 3-5cm, marcando como evento clave al logro de la resección adecuada, ya que la recurrencia está relacionada a los márgenes positivos.12
En una serie de casos de 19 pacientes recopilados 2002 al 2016 lograron márgenes libres de lesión con un ancho de 0.5 a 3 cm. El margen medio fue de 1.67 cm con lo que se obtuvo márgenes negativos en todos los pacientes con tumor primario, con una supervivencia libre de recurrencia de 84 meses.15
Huis in´t Veld et al. publicó un estudio prospectivo de 279 pacientes, en donde concluyó que el ancho del margen no influyó en la tasa de recurrencia, proponiendo que el márgen negativo de >1mm es tan bueno como el márgen amplio, sin tener la necesidad de resecciones adicionales u otras terapias coadyuvantes. Sin embargo, existe una discrepancia entre los margenes macroscópicos y microscópicos, encontrando una diferencia de 22mm entre estos márgenes, lo que muestra que el tumor crece microscópicamente mas allá del tumor palpable y visible. Lo que provoca altas tasas de recurrencia. 16
Posterior a la resección debe retrasarse la reconstrucción quirúrgica hasta lograr margenes negativos mediante un examen completo tanto de los márgenes periféricos como profundos. 2
Algunos pacientes son referidos por una cicatriz posterior a la escisión, con DFSP extirpado microscópicamente de manera incompleta, resultando un enigma su manejo en ausencia de evidencia convincente para guiar los márgenes de resección adicional. En estos casos se ha sugerido la opción de re-escisión conservadora, la cual consiste en una escisión elíptica de la cicatriz, el lecho tumoral y la fascia profunda, abarcando un margen de al menos 1 cm, permitiendo el cierre primario. Se ha reportado una recurrencia local del 0%, siendo esta una técnica alternativa para evitar la reintervención para reconstrucción. 17
Gauthier et al. estudiaron el riesgo de metástasis y enfermedad residual. Proponiendo que en caso de que existan márgenes quirúrgicos positivos después de una escisión amplia, se puede colocar un injerto de piel de espesor parcial para facilitar el seguimiento de recurrencia siguiendo el protocólo de espera y observación. Encontrando en su estudio que no hay un impacto en la supervivencia general o en la tasa de amputación. Por lo que esta técnica podría ser una opción para prevenir una cirugía mórbida.18
Por último, un metanalisis incluyó las publicaciones que hacian referencia a los márgenes del DFSM antes del 2020, concluyendo que los márgenes de < 3 cm se asocian a una recidiva baja o nula. 19
Cirugía de Mohs
La cirugía de Mohs es una técnica alternativa a la escisión local amplia, permitiendo analizar el 100% de los márgenes del tumor e identificar la extensión microscópica para así extirparla completamente conservando la mayor parte de tejido sano. 20
A pesar de que se recomiendan margenes quirúrgicos de 3cm, en algunas ocasiones la topografía de la lesión no permite cerrar fácilmente sin reconstrucción como son las extremidades distales o regiones de la cabeza y cuello. Por lo tanto, en estos casos se recomienda tomar márgenes mas pequeños o realizar cirugía de Mohs para prevenir procedimientos estéticos con mayor morbilidad y descenlaces desfavorables.
Al elegir la cirugía de Mohs se recomienda un margen micrográfico tridimencional de 1 cm. Sin embargo en algunos estudios retrospectivos se ha observado que los márgenes menores de 2 cm se han asociado a un mayor riesgo de recurrencia. Comparando las tasas de recurrencia entre pacientes tratados con cirugía micrográfica vs escisión local amplia se ha observado una recurrencia de 1.11% vs 6.32% respectivamente.13 El registro Español de Cirugía de Mohs (REGESMOHS) evaluó a 163 pacientes, reportando una recurrencia de 9.7 casos por 1000 personas por año, con una mediana de 28.6 meses.21
Algunos expertos no toman a la cirugía de Mohs como la técnica de elección al ser un procedimiento mucho más complejo, costoso y tardado por lo que frecuentemente no se realiza en todos los centros hospitalarios. Otra desventaja de esta técnica es que las células tumorales pueden ser confundidas con las células fusiformes de la dermis en cortes congelados. Por otra parte, también su función es limitada en casos de invasión a la fascia o músculo en donde se torna difícil la comprobación del margen profundo. 20
Se ha descrito la técnica de Mohs lento, en el que se envían muestras señaladas para cortes permanentes fijados en formalina y embebido en parafina;22 Sin embargo, tiene las desventaja de prolongar el procedimiento por más días y requiere varias consultas. El corte permanente tiene la ventaja de permitir la tinción de inmunohistoquímica para confirmar los márgenes claros. Al comparar los datos de recurrencia entre la cirugía de Mohs convencional y Cirugía de Mohs lento se ha demostrado en ambas técnicas, una tasa de recurrencia baja del 1% y 7.3% respectivamente.23
Tratamiento médico
En los ensayos recientes se propone que el DFSP no es sensible a la quimioterapia, por lo que no debe utilizarse como tratamiento de primera línea.
El tratamiento médico se indica principalmente en casos de tumores primarios inoperables, enfermedad local recurrente inoperable y en metástasis. 24
El imatinib es un inhibidor multicinasa que actúa sobre la vía del receptor de crecimiento derivado de plaquetas (PDGFR). Esta vía es relevante en la patogenia del DFSP, activándose por la traslocación y fusión de los genes que codifican PDGFB y COL1A1. 25
Antes del inicio del tratamiento se recomienda detectar el gen de fusión COLA1A-PDGFB, ya que este fármaco actúa sobre este receptor de las células neoplásicas, bloqueando su actividad tirosina quinasa.24 Se ha comprobado su eficacia en DFSP localmente avanzado o metastásico, con respuestas parciales entre el 50-80% de los casos.26
La dosis inicial recomentada de imatinib es de 400mg/día, encontrado la misma eficacia que a mayor dosis, teniendo menos efectos adversos. Ante falta de respuesta se sugiere incrementar la dosis de 600-800mg, esperando el efecto máximo entre los 5-6 meses, sin embargo la duración del tratamiento aún no esta definida.
Se han planteado nuevos inhibidores tirosina quinasa, como sunitib, sorafenib y pazopanib, principalemente en casos de resistencia al imatinib.24
Radioterapia
La radioterapia es una opción de tratamiento para los casos en los que el tumor es inoperable, aquellos que tienen márgenes posoperatorios positivos, en casos recurrentes y también se puede considerar en los casos en los que una escisión amplia causaría un deterioro funcional o cosmético.
La dosis recomendada es de 2 Gy cinco veces por semana, hasta una dosis total 60-66 Gy en los casos de evidencia microscópica y 66-70 Gy en los casos de evidencia macroscópica. 27,28
En una revisión sistemática se comparó la recurrencia local en los casos de cirugía y cirugía más radioterapia postoperatoria, sin encontrar diferencia significativa entre los dos grupos. Por lo tanto la radiación adyuvante del lecho no se recomienda. 29
Pronóstico
Jun Kim et al. en su serie de casos reportó como factor de mal pronóstico a la edad avanzada, el componente fibrosarcomatoso de alto grado, la recurrencia,el número de mitosis, los margenes positivos y el sitio de afección, en donde la cabeza, cuello y las extremidades se asociaron con alta tasa de recurrencia posiblemente por un tejido celular subcutáneo más delgado que otras áreas. 30
Seguimiento
Aun no se ha establecido el tiempo de seguimiento de los pacientes con DFSP; Sin embargo, el objetivo es la detección temprana de recurrencias y metástasis.
Se recomienda la evaluación clínica de estos pacientes cada 6 meses al menos durante 5 años posteriores a su diagnóstico.13
Discusión
El dermatofibrosarcoma es un sarcoma maligno derivado de los fibroblastos dérmicos, considerado de grado bajo-intermedio. Su diagnóstico oportuno es importante para un adecuado tratamiento y mejor pronóstico. El tratamiento de elección es quirúrgico, por lo que el cirujano dermatólogo tiene el desafío de evitar cirugías amplias con una obtención del control oncológico óptimo;Siendo el mayor de los retos la planeación quirúrgica de cada caso, tomando en cuenta la biología del tumor, la topografía que afecta y las características de cada paciente.
Referencias