
Rev Med UAS
Vol. 13: No. 2. Abril-Junio 2023
ISSN 2007-8013
Eric Alberto Loza-Ramírez1, Francisco Iván Guerrero-Amador2, Lucia Zatarain-Bayliss3
*Autor de correspondencia: Dr. Eric Alberto Loza-Ramírez.
Av. Álvaro Obregón 1422 Nte. esquina con Mariano Abasolo, Colonia Tierra Blanca, Culiacán, Sinaloa. C.P. 80030
Tel. (667) 7580500 Correo electrónico: ericlr89@gmail.com
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v13.n2.011
Texto Completo PDFRecibido: 15 de octubre 2020, aceptado 14 de junio 2022
RESUMEN
El cáncer de mama es una enfermedad de evolución natural compleja que sigue siendo un gran problema de salud pública a nivel mundial. La mastografía es el método de tamizaje para la detección precoz del cáncer de mama que ha demostrado mayor utilidad y que ayuda a disminuir la mortalidad, sin embargo, el ultrasonido mamario es una valiosa herramienta diagnóstica complementaria, que ayuda a realizar un mejor análisis de las lesiones y que incorpora herramientas como el Doppler o la elastografía. Por medio del Doppler se puede valorar el grado de vascularidad de la lesión, así como los distintos comportamientos de los vasos, lo que ayuda a hacer una aproximación mayor para determinar si una lesión cumple con características benignas o malignas. El índice de Resistencia es un parámetro del Doppler espectral que ha demostrado un incremento en lesiones malignas.
Palabras Clave: Cáncer de mama, Ultrasonido Doppler, Doppler espectral, Índice de resistencia.
ABSTRACT
Breast cancer is a complex natural history disease that continues to be a major public health problem worldwide. Mammography is the screening method for the early detection of breast cancer that has proven most useful and that helps reduce mortality, however, breast ultrasound is a valuable complementary diagnostic tool, which helps to perform a better analysis of the breast lesions and incorporating tools such as Doppler or elastography. The examination with Doppler ultrasound shows the degree of vascularity of the lesion, as well as the different comportments of the vessels, which helps to make a greater approximation to determine if a lesion exhibit benign or malignant characteristic. The Resistance index is a spectral Doppler parameter that has shown an increase in malignant lesions.
Keywords: Breast Cancer, Doppler Ultrasound, Spectral Doppler, Resistance Index.
INTRODUCCIÓN
El cáncer de mama es una enfermedad con una evolución natural compleja por lo que sigue siendo un gran problema de salud pública llegando a ser la primera causa de muerte por neoplasia en la mujer en el ámbito mundial, con cerca de 500 mil muertes cada año, de las cuales el 70% ocurre en países en vías de desarrollo.1,2
En México, a partir de 2006, el cáncer de mama ocupa el primer lugar de mortalidad por tumor maligno en mujeres mayores de 25 años, posicionándose por encima del cáncer cérvico-uterino. En el 2010 la tasa estandarizada de mortalidad fue de 18.7 por cada 100 mil mujeres de 25 ó más años, lo que representa un incremento del 49.5% en los últimos 20 años.1,3
Por esto se ha llevado a cabo un estudio exhaustivo en los métodos diagnósticos para su detección oportuna, la cual ha evolucionado mayormente con la introducción de la clasificación breast imaging reporting and data system (BI-RADS) en 1992 por el Colegio Americano de Radiología (ACR), la cual actualmente se ha convertido en una herramienta indispensable y al ser agregada a los informes mastográficos, ultrasonográficos y de resonancia magnética (incluyendo los dos últimos desde las dos últimas ediciones) permite estandarizar el vocabulario y asignar un valor predictivo de sospecha de malignidad de acuerdo con criterios morfológicos bien establecidos, para así tomar la actitud adecuada de manejo en cada caso.4,5 (Cuadro 1)
EL ULTRASONIDO COMO MÉTODO DIAGNÓSTICO
La mastografía es el método de tamizaje para la detección precoz del cáncer de mama que ha demostrado mayor utilidad, siendo el único método de imagen que ha demostrado disminución en la mortalidad por cáncer de mama de hasta un 30%, lo que ocurre siempre y cuando se realice de manera periódica y con un estricto control de calidad.1,3 Sin embargo, el ultrasonido (US) mamario es una valiosa herramienta diagnóstica complementaria a la mastografía, ya que es un estudio accesible y que no utiliza radiación iónica, pero no se recomienda su uso único como método de tamizaje para cáncer, aunque si puede ayudar a la valoración de primera vez en pacientes menores de 40 años con sintomatología. Para ello se requieren equipos de alta resolución, así como experiencia y conocimiento de la anatomía de la glándula mamaria y su evaluación por ecografía.6

Se han realizado múltiples estudios que denotan la alta importancia del US para la detección y caracterización de lesiones mamarias, uno de ellos analiza el papel del US en el diagnóstico de las masas palpables de mama, realizándolo de manera retrospectiva con los ultrasonogramas de 30 mujeres con masas palpables categorizadas como BI-RADS 0 por mastografía. En este caso, por medio de ultrasonido las lesiones fueron re-categorizadas a BI-RADS 4 y 5, correlacionándolas posteriormente con hallazgos histopatológicos, revelando presencia de malignidad en el 56.7% de los casos.7-9
Por medio del US se pueden realizar otras evaluaciones haciendo uso de aplicaciones incorporadas para una mejor caracterización de las lesiones, tales como la elastografía y el Doppler, la primera de ellas evalúa la consistencia o dureza de los tejidos, definiéndola como una lesión blanda, intermedia o dura; el Doppler, por su parte permite evaluar los trayectos vasculares, así como sus características midiendo las velocidades de los flujos y sus índices de resistencia; que aplicado a la valoración de lesiones mamarias ayuda a detectar si estas presentan formaciones vasculares.1,3,10-13 Aunque la vascularización y la evaluación de la elasticidad en elastografía son consideradas características secundarias, no definitorias del grado de sospecha.5
EL NÓDULO COMO LESIÓN DE SOSPECHA
Stavros y cols. en 1995, estudiaron el aspecto ecográfico de las lesiones sólidas y definieron características morfológicas que, por su frecuente asociación con cáncer, permitieron clasificar los nódulos mamarios sólidos en tres grupos, según su riesgo relativo de cáncer de mama: nódulo probablemente
benigno, nódulo probablemente maligno y nódulo indeterminado.14 En el caso del BI-RADS en su 5ª edición el número de descriptores se redujo de 7 a 5 (forma, orientación, márgenes, ecogenicidad y características ecográficas posteriores).5
Los nódulos sólidos son aquellos que se caracterizan por ser hipoecogénicos, en los que se aprecia una sombra acústica tras el paso del sonido. Por su parte los quistes, varían su ecogenicidad de hipoecóicos a anecóicos y producen un refuerzo del sonido tras la amplificación del mismo al atravesar el medio líquido.10,11
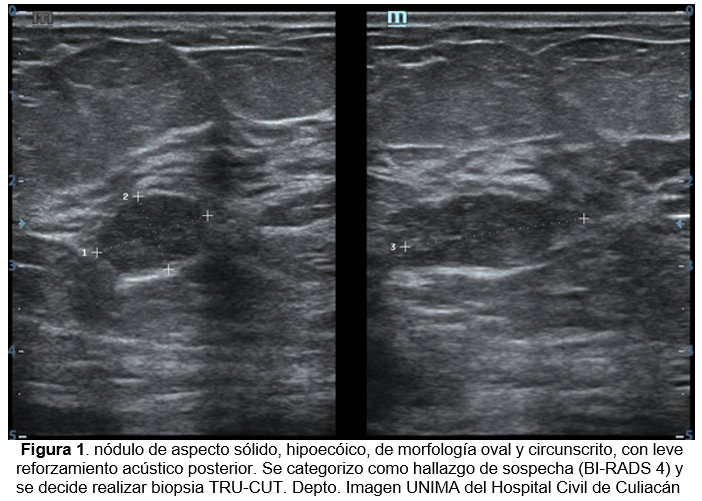
Un nódulo es indeterminado cuando no tiene características benignas ni malignas, y se denomina como maligno, cuando presenta características ecográficas como: contornos espiculados, orientación no paralela a la piel (más alto que ancho), márgenes angulados, con comportamiento al haz de ultrasonido como hipoecogénicos en su mayoría (Figura 1), con sombra acústica posterior; presencia de calcificaciones puntiformes, extensión ductal y microlobulaciones, de los cuales de acuerdo con el BI-RADS la forma, orientación y margen son los más específicos al momento de diferenciar una lesión benigna de una maligna. Esta caracterización muestra una sensibilidad del 98.4% y un VPN de 94.5% para malignidad, así como con una especificidad de 67.8%.5,10-12,15,16
EL DOPPLER Y SU UTILIDAD EN EL ANÁLISIS DE LA ANGIOGENESIS TUMORAL
El ultrasonido Doppler proporciona imágenes a partir de construcciones que son dependientes del cambio de frecuencias presentado en pulsos ultrasónicos dispersos del movimiento de las células sanguíneas, lo que muestra el flujo sanguíneo en tiempo real y codificado por colores por la combinación de las características del modo M y el efecto Doppler.17 La función del Doppler Color y Doppler Poder son ampliamente usadas para demostrar la neoangiogénesis tumoral, sobrepasando a la ecografía en escala de grises en el estudio de masas sospechosas.12,17
En la mama tanto las lesiones benignas como las malignas pueden mostrar incremento en la vascularidad, sin embargo se observa mayormente en las lesiones malignas, y ese incremento es causado por la neoangiogénesis.18
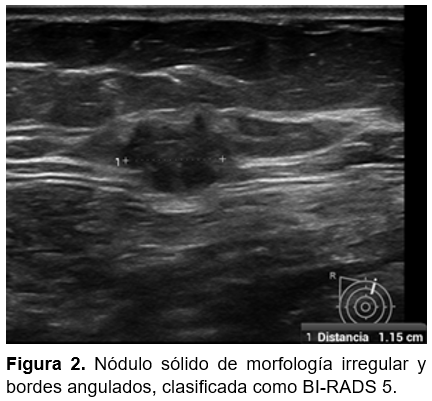
La asociación entre la angiogénesis y el cáncer fue descrita por primera vez por Folkman en 1971.19 La angiogénesis es definida como la neoformación de vasos que nacen de los capilares o microvasos preexistentes; su formación es muy bien conocida y se considera esencial para el crecimiento tumoral y la formación de metástasis. Mientras las lesiones mamarias benignas poseen vasos nativos maduros, generalmente capsulares de trayecto recto o curvo, con calibre regular y con distribución armoniosa, los tumores malignos secretan factores angiogénicos que estimulan el crecimiento de los vasos anómalos, esto debido a que las células cancerosas metabólicamente activas demandan mayor oxígeno y nutrientes de lo que obtienen a través de los vasos nativos lo que produce hipoxia, es este estado hipóxico lo que estimula la formación de nuevos vasos para mantener la homeostasis metabólica del tumor (Figura 2). Se cree que la neoangiogénesis es causada por la proteína angiogénica que genera una red vascular local altamente densa en capilares, loops y shunts arterio-venosos, por lo cual los neovasos tienen una apariencia tortuosa, son de calibre irregular y de paredes finas, sin presencia de músculo liso en su pared, con una ramificación aleatoria o “caótica” y se presenta generalmente hacia la periferia de la lesión, lo que permite que la célula maligna crezca más allá de un punto en particular (el tumor no puede crecer más de 1 a 2 mm sin reclutar nuevos capilares sanguíneos).17-26
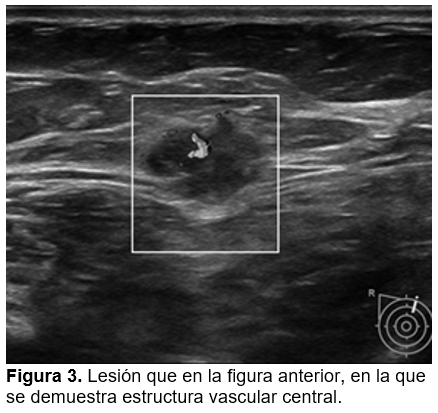
El fundamento de la imagen de Doppler en el cáncer de mama se basa en la angiogénesis del tumor y el gradiente de vascularidad de la masa.22 Se ha demostrado que el flujo en la enfermedad benigna es subjetivamente menor que en lesiones malignas, mientras que una alta señal Doppler del flujo sanguíneo tumoral se asoció con mayor extensión de la enfermedad (Figura 3).24,27
Por lo anterior, se podría pensar que una vascularización aumentada en Doppler color (DC) incrementa la posibilidad de malignidad de un nódulo. Aunque hay que tomar en cuenta que con DC no es posible identificar los capilares, pero sí los vasos aferentes e intra-tumorales de mayor calibre.12,17-21 Por otra parte, es bien conocida la sensibilidad del ultrasonido Doppler poder (DP) o Angio Doppler para la valoración de volúmenes de flujo rápido y más bajo, además debido a que el DP tiene menos dependencia del ángulo de insonación y no presenta artefactos de “aliasing”, puede demostrar mejor la continuidad vascular y facilitar la localización del punto de muestreo del análisis espectral que el Doppler color, lo que ayuda a hacer una mejor valoración de la lesión.19,26,28
Las señales de flujo sanguíneo en el Doppler color son más numerosas en los cánceres de mama, sin embargo, la hipervascularización en una lesión mamaria, por sí misma, no es un adecuado predictor de malignidad, ni la apariencia avascular debe ser interpretada cómo signo de benignidad, existiendo así una gran superposición entre la irrigación de las lesiones benignas y malignas.12,17-21,28 Por otro lado el Doppler poder, al ser tan sensible a los flujos vasculares, puede hacer que algunas lesiones benignas parezcan hipervasculares, lo que complica aún más el poder distinguir lesiones malignas de benignas sólo con hallazgos objetivos de vascularización.28
Para el adecuado análisis de las lesiones por este método hay que tener en cuenta también los aspectos técnicos del equipo, tomando en cuenta que la exploración se realiza utilizando un transductor lineal de alta frecuencia 7-13 MHz, y se recomienda tener máximo ajuste de ganancias manteniéndolo entre 70 a 90% (ajustando de acuerdo a cada paciente para evitar artefactos), con un PRF entre 7 a 10 khz, filtro de pared lo más bajo posible (50 a 100 Hz máximo), algoritmo apropiado para remover artefactos de movimiento y mantener la caja de muestra sin angulación, así como recordando no someter a la lesión a una compresión excesiva al momento de la exploración para evitar la limitación del flujo vascular. 18,19,26
PATRONES VASCULARES Y ANALISIS ESPECTRAL
Se han realizado diversos trabajos que indican que el patrón de vascularidad podría ayudar a diferenciar lesiones malignas de las benignas, los cuales han demostrado que los vasos tumorales pueden presentar altas variaciones de frecuencia sistólica y velocidades de flujo en la onda continua del ultrasonido en los carcinomas. Como ya se había mencionado previamente, los vasos tumorales carecen de musculatura y están estructurados de una manera similar que los capilares largos o sinusoides, además que su calibre fluctúa y pierde la característica de disminución en sus extremos distales, muestran obstrucciones, así como trayecto y distribución anormal y pueden presentar shunts arteriovenosos, todo esto condiciona alteraciones en la velocidad de flujo sanguíneo que es manifestado como aceleración de flujo en el ultrasonido Doppler; por todo lo anterior se puede explicar los altos índices de resistencia (IR) en lesiones malignas reportados en distintos estudios.26,27
Al utilizar el Doppler en la evaluación ultrasonográfica se puede realizar un análisis cualitativo y cuantitativo de la vascularización de las lesiones, en el análisis cualitativo se pueden valorar: el número de vasos en la lesión clasificándola como avascular (sin vasos detectables), hipovascular (una o dos arterias) e hipervascular (tres o más arterias); la distribución de vasos tumorales (central, periférico y/o penetrantes) y su morfología (lineales o regulares y desordenados o irregulares); mientras que en el análisis cuantitativo: se realiza una evaluación espectral de los vasos (obteniendo valores de índices de resistencia y pulsatilidad, velocidad sistólica máxima y velocidad diastólica final mínima).22,26 Por su parte, se han realizado estudios basados en el análisis cualitativo donde Bhargva et al. describe el patrón de vascularidad tumoral como: tipo 1.- avascular, tipo2.- un solo vaso, tipo 3.- múltiples vasos periféricos y tipo 4.- vasos intratumorales; mientras que los patrones vasculares descritos por Raza y Baum son: sin vasos, presencia de vasos centrales o periféricos (vasos dentro de la lesión o de aspecto curvado a lo largo de la lesión) y vasos penetrantes (vasos que surgen del borde de la lesión y la atraviesan, con o sin un patrón de ramificación); en donde se ha demostrado que la presencia de vasos penetrantes con entrada directa a la lesión sin pasar a través de los vasos capsulares asociado a características morfológicas de sospecha descritos en el BI-RADS ecográfico representan un hallazgo altamente sugestivo de malignidad y se correlacionan con resultados histopatológicos con alta especificidad y valor predictivo negativo, así mismo se ha evaluado si el grado de penetración de los vasos hacia la lesión aumenta el grado de sospecha, lo cual no muestra una correlación significativa con la presencia de malignidad.18,19,25,29 Utilizando estos criterios de sospecha, el Doppler color posee una sensibilidad variable para cáncer, evaluada en 68-99% y una especificidad de 43-97%, VPP de 58 a 88% y VPN de 80 a 100% según diferentes estudios, mostrando esta gran variación de acuerdo con la técnica utilizada (Doppler color o Doppler poder). 12,17-21
El DP no parece tener una clara ventaja clínica sobre el DC, sin embargo con su capacidad superior para detectar flujo sanguíneo, amplia la capacidad de diagnóstico del análisis espectral en pacientes con tumores que parecen avasculares en el Doppler color.28
Una revisión llevada a cabo por Miltz, demuestra mediante su serie de 400 nódulos biopsiados que la presencia de flujo al Doppler no es predictor de malignidad. De estos presentaron flujo el 45% de las lesiones benignas, el 80% de las malignas invasoras y el 25% de las malignas in situ. Al considerar sólo el “carácter vascularizado o no” de un nódulo como criterio de malignidad, los resultados muestran baja sensibilidad, especificidad y valores predictivos. Queda así en evidencia que el aumento de vascularización al Doppler color como factor único de caracterización no puede establecer el diagnóstico de malignidad (Figura 4).17
Otro estudio de tipo retrospectivo realizado en 2009, en el cual se evaluaron los casos de 2426 pacientes valoradas por medio de ultrasonido en modo B y utilizando el Doppler, mostraron que la frecuencia de malignidad con una evaluación de manera integral del BI-RADS las lesiones dentro de la categoría 4a fue de 2,7%, claramente inferior a las categorías 4b y 5 (64% y 100%, respectivamente), datos establecidos en la literatura. Sin embargo, los cánceres de mama representaron sólo el 1,6% de las lesiones, las cuales aumentaron de categoría 3 a 4a basado en los resultados del análisis del flujo vascular por Doppler. Mientras que al analizarlas sólo con US en Modo B se obtiene un resultado de malignidad por debajo de lo reportado en la literatura, la presencia de flujo en el Doppler es superior desde el punto de vista de captación de neoplasias malignas, pero con el inconveniente de también captar lesiones que pueden dar falsos positivos.21
Por otra parte, en cuanto al análisis cuantitativo, se han realizado diversos estudios en los que se evalúan los distintos parámetros arrojados durante el análisis espectral de las estructuras vasculares en las lesiones mamarias, de los cuales a los que se ha prestado mayor atención es al índice de resistencia (IR) y el índice de pulsatilidad (IP), y de estos principalmente al IR ya que no depende del ángulo de insonación y se puede calcular con precisión incluso en vasos pequeños.26
Un estudio realizado en 1992, reporta los hallazgos obtenidos del análisis de 112 pacientes con lesiones mamarias palpables y no palpables, siendo valoradas por medio de ultrasonido con aplicación del Doppler color y su posterior correlación con resultados de estudios histopatológicos de las lesiones de importancia, el cual reporta 39 casos de malignidad, de los cuales el más prevalente fue carcinoma ductal invasivo, y en sólo 2 de ellos no se detectó vascularidad al momento de la valoración con US DC, mientras que de las 73 lesiones benignas analizadas, solo 10 no presentaron vasculatura. Hacen mención que la diferencia entre lesiones benignas o malignas recae sobre los índices evaluados, en este caso siendo valorados la velocidad de flujo máxima, el índice de resistencia y el índice de pulsatibilidad, siendo estos ligeramente mayores en las lesiones malignas, reportando que el IR de 0.70 es el mejor valor de corte para diferenciar nódulos malignos con 82% de sensibilidad, 81% de especificidad, 70% de VPP y 89% de VPN.20
En otro estudio de manera retrospectiva se evaluaron 104 pacientes con masas en mamá, 64 lesiones benignas en 62 pacientes y 42 malignas en 42 pacientes, en donde los principales valores del IR en lesiones benignas fue de 0.62 ± 0.095 mientras que en las malignas fueron de 0.74 ± 0.097 con un rango entre 0.50 y 0.92; determinando que el IR excede los 0.7 en más del 80% de las lesiones malignas, con una sensibilidad y especificidad de 80.9 y 89.1% respectivamente, con un valor predictivo positivo de 82.9 y negativo de 87.7%.27

Uno más, en el que se analizaron 100 pacientes de los cuales 35 presentaban lesiones malignas, siendo la de mayor frecuencia fue carcinoma ductal invasivo (25), de las cuales 74.3% presentaban flujo detectable al Doppler color (central en su mayoría), el IR medio fue de 0.73 ± 0.09 y el IP medio fue de 1.09 ± 0.20, ambas relativamente mayor en comparación con lesiones benignas, y se determinó un VPP en la lesión maligna de 92% combinando tanto la ecografía en Modo B cómo los patrones en Doppler color.31
Por último, otro en el que se analizaron 71 mujeres de las cuales 36 fueron caracterizadas como carcinomas (carcinoma ductal invasivo en su mayoría) y 35 como lesiones benignas (18 fibroadenomas y 17 casos de enfermedad fibroquística). Se determinaron el flujo de velocidad sistólica máxima (Vmax), velocidad diastólica mínima final (Vmin), el IP y el IR; y se demostró que el IP y el IR fueron significativamente mayores en los tumores malignos en comparación con las lesiones benignas, mientras que la relación entre densidad microvascular y estos parámetros espectrales no fue estadísticamente significativo, lo que denota que los parámetros espectrales no refleja la cantidad de proliferación microvascular intratumoral, sin embargo aunque Vmax no ayuda para diferenciar lesiones benignas de malignas, si pudiera ser un buen valor predictivo de la densidad microvascular (DMV), principalmente en lesiones sólidas lo que podría predecir un pobre pronóstico en los carcinomas invasivos de mama, ya que actualmente se cree que es uno de los factores pronósticos más importantes para la enfermedad.32
Actualmente el análisis detallado de los diferentes criterios del Doppler no han sido bien establecidos en la patología mamaria ni se tienen considerados como tal dentro de los descriptores ecográficos del BI-RADS, sin embargo el índice de resistencia puede ser usado como auxiliar en el diagnóstico con imágenes en escala de grises, ya que en diversos estudios se ha reportado aumento del IR, que como ya se mencionó no existe un valor de corte estándar, pero son diversos autores los que hacen referencia a que por arriba de 0.70 indican malignidad y mientras que otros mencionan que por debajo de 0.85 generalmente indican benignidad, lo que sí se ha visto es que los índices de resistencia son significativamente más altos en las lesiones malignas. Aunque se ha especificado que por si sólo el IR no es un parámetro específico para determinar la malignidad de una lesión, la combinación de la ecografía en Modo B y el estudio Doppler (color, poder y espectral), tomando en cuenta la hipervascularidad, penetración de los vasos en el tumor y patrón de ramificación desordenado son características estadísticamente significativas para diferenciar las lesiones malignas de las benignas, incrementando así la sensibilidad y especificidad del examen ecográfico para la detección de lesiones con alta probabilidad de ser malignas.22,26,27,30,31,33
OTRAS EVALUACIONES POR MEDIO DE ULTRASONIDO EN LESIONES MAMARIAS DE SOSPECHA
El uso de US con medios de contraste es una importante herramienta de diagnóstico que puede revelar información adicional acerca de la vascularidad de las lesiones, aunque es una modalidad relativamente nueva y sus aplicaciones siguen siendo evaluadas. De momento se ha observado que no existen una diferencia significativa en el patrón de realce entre las lesiones benignas y malignas, aunque se observó un realce intenso en las lesiones malignas.22
El cáncer de mama, al ser una enfermedad altamente heterogénea con una gran variedad de presentaciones clínicas y comportamiento, condiciona un amplio rango a las respuestas del tratamiento y distintos pronósticos. Actualmente se hace hincapié en que el rol más importante del Doppler en la mamá es determinar los beneficios y el éxito de la terapia antiangiogénica en los pacientes. El manejo del cáncer de mama ha cambiado en los últimos años a medida que continúa evolucionando el estudio de su biología molecular, utilizando terapias dirigidas basadas a los subtipos genéticos, hormonales o inmunohistoquímicos. Aunque por el momento no existe una asociación significativa entre la inmunohistoquímica de los tumores y los diferentes parámetros obtenidos del Doppler color y espectral.23,29
CONCLUSIÓN
El cáncer de mama es una enfermedad heterogénea que sigue siendo un reto tanto en el diagnóstico como en el tratamiento y su estudio se muestra en constante evolución.
El ultrasonido es una herramienta útil como estudio complementario para la caracterización de las lesiones mamarias que ayuda a identificar si se trata de una lesión sólida o quística y que toma en cuenta distintas características para denominar si una lesión es sospechosa de malignidad o no, de ellas las que más se han asociado con el grado de malignidad es la forma, los márgenes y la orientación. Además también puede demostrar a través del Doppler si la lesión presenta flujo vascular, lo cual ha tomado importancia para su estudio, ya que dentro de la clasificación BI-RADS no existe un apartado específico que describa esta característica, y se ha demostrado que la neovascularización o angiogénesis muestra una relación estrecha con el desarrollo y proliferación de cáncer. Actualmente se ha demostrado que aunque puede existir vascularidad tanto en lesiones benignas como malignas, es más frecuente encontrarla en estas últimas, en las cuales las estructuras vasculares muestran distintos patrones de crecimiento, morfología, distribución y comportamiento al Doppler espectral que hacen de mayor sospecha a la lesión. A través del Doppler espectral se pueden analizar distintos parámetros del flujo vascular de los vasos tumorales, de ellos el que se ha estudiado mayormente es el índice de resistencia ya que es un valor que se puede determinar de manera más sencilla, ya que no depende del ángulo de insonación; distintos autores han demostrado que los vasos tumorales muestran un mayor índice de resistencia, generalmente >0.70, en lesiones malignas que en las benignas. Sin embargo, hasta el momento no se ha logrado establecer un punto de corte específico para tomarlo en cuenta por si sólo como una característica de malignidad, aunque se ha descrito que al combinar los descriptores ecográficos del BI-RADS con los hallazgos por el Doppler y un IR >0.70 aumenta el grado de sospecha para denominar a la lesión como maligna, no obstante el Gold estándar para el diagnóstico final sigue siendo la biopsia y el estudio histopatológico. Con esto vemos una mayor aproximación hacia el diagnóstico de la patología mamaria, lo cual ayuda a dar un mejor manejo y pronta atención a aquellas pacientes que lo requieren.
AGRADECIMIENTOS
Agradezco a los maestros y tutores por la oportunidad y el apoyo otorgado para la realización de este trabajo, tanto en la parte teórica como en la metodológica, así mismo agradezco a los directivos y encargados del área de imagenología diagnóstica del Hospital Civil de Culiacán y a la revista por el espacio que nos abre para esta publicación.
DECLARACIÓN DE CONFLICTO DE INTERÉS
El presente artículo es de carácter académico e informativo y conforme a lo estipulado con las normas del Comité Internacional de Editores de Revistas Médicas, se declara que no conlleva ningún conflicto de interés para los autores.
Referencias