
Rev Med UAS
Vol. 12: No. 4. Octubre-Diciembre 2022
ISSN 2007-8013
Alan Rigoberto Carvajal-Sepúlveda1*, Fred Morgan-Ortiz1, Everardo Quevedo-Castro1, Guadalupe López-Manjarrez2, Fred Valentín Morgan-Ruiz1, Perla Yareli Gutiérrez-Arzapalo3
* Correspondencia: Dr. Alan Rigoberto Carvajal Sepúlveda.
Prol. Álvaro Obregón 1422, Tierra Blanca, 80030 Culiacán Rosales, Sin. alancarvajal@hotmail.com , 6674918936
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v12.n4.011
Texto Completo PDFRecibido 16 de agosto de 2022, aceptado 20 de octubre de 2022
RESUMEN
La preeclampsia es una de las principales causas de morbimortalidad materna, es una enfermedad específica del embarazo caracterizado por trastornos hipertensivos que pueden estar asociados a diferentes grados de proteinuria, con posibilidad de evolucionar a diferentes espectros clínicos de severidad. En presencia de alguna de las características marcadas como “severas”, los pacientes pueden clasificarse automáticamente. La forma activa de la vitamina D juega un papel regulador en el proceso de placentación, la cual se une a su receptor de vitamina D (VDR), que se expresa en altas cantidades en el trofoblasto y tejido decidual en función de la carga genética y la síntesis de vitamina D endógena. Cuando hay una disminución en la carga de VDR, el trofoblasto comienza a crecer e invadir de manera desorganizada, la invasión no llega a ser funcional, porque la desorganización hace que los espacios lagunares no sean alcanzados correctamente, comprometiendo el suministro de oxígeno de la unidad fetoplacentaria. Debido a estos eventos ocurre una disminución del factor de crecimiento tipo 3 (TGFB3), encargado de inducir el crecimiento placentario, neovascularización y aporte nutrimental al trofoblasto invasor, contribuyendo a la patogenia de la preeclampsia.
En general, resultados de distintos estudios sugieren que los niveles disminuidos de 25(OH) D en el embarazo pueden estar asociados con la preeclampsia en subgrupos específicos de la población.
Palabras Clave: Preeclampsia, vitamina D, hipovitaminosis D, embarazo
ABSTRACT
Preeclampsia is one of the main causes of maternal morbidity and mortality and it is a pregnancy-specific disease characterized by hypertensive disorders that may be associated with different degrees of proteinuria, with the possibility of evolving to different clinical spectrum of severity. In the presence of any of the characteristics marked as “severe”, patients can automatically be classified.
The active form of vitamin D plays a regulatory role in the placentation process, usually reaching its vitamin D receptor (VDR Vitamin D Receptor), which is expressed in the trophoblast and decidual tissue depending on the genetic load and patient's endogenous vitamin D synthesis. When there is a decrease in the VDR load, the trophoblast begins to grow and invade in a disorganized manner; however, the invasion doesn’t become functional, since the disorganization causes the lacunar spaces don’t be reached correctly, compromising the oxygen supply of the fetoplacental unit. Those actions trigger a decrease in growth factor type 3 (TGFB3) which induces placental growth, neovascularization and nutrimental output on the invasor trophoblast, contributing to the pathogenesis of preeclampsia.
Keywords: preeclampsia, vitamin D, vitamin D deficiency, pregnancy.
Introducción
La preeclampsia es una de las causas principales de morbimortalidad materna, es una enfermedad específica del embarazo caracterizado por trastornos hipertensivos que pueden estar asociados a distintos grados de proteinuria, con la posibilidad de evolucionar a distintos espectros clínicos de severidad. Los criterios diagnósticos se han mantenido a lo largo de la última década, con distintos debates en su clasificación, estableciéndose 5 estados hipertensivos asociados al embarazo: preeclampsia, preeclampsia con datos de severidad, eclampsia, hipertensión gestacional e hipertensión crónica con preeclampsia sobreagregada 1,2.
Se define como “preeclampsia” a la aparición de cifras tensionales mayores a 140/90 mmHg después de la semana 20 de gestación acompañada con proteinuria definida como mayor de 300 mg en 24 horas (o 150 mg en 12 horas, relación proteínas/creatinina >0.3 mg/dl, examen general de orina con >2 marcas de proteínas), en ausencia de criterios clínicos-laboratoriales de severidad. En presencia de alguna de las características marcadas como grado de severidad, automáticamente se puede clasificar a las pacientes como “preeclampsia severa”, las entidades que nos permiten dar pauta a dicho diagnóstico son: hipertensión con cifras sistólicas >160 o diastólicas >110, conteo plaquetario menor a 100,000, disfunción hepática caracterizada por elevación de transaminasas al doble de su límite superior (ALT, AST >70), dolor epigástrico o en cuadrante superior derecho de forma persistente que no responde a medicamentos u otros diagnósticos alternativos; daño renal caracterizado por creatinina >1.1 en ausencia de otra explicación, síntomas de vasoespasmo a nivel central como alteraciones visuales (escotomas, fosfenos, amaurosis, etc.), acúfenos y cefalea 2,3. La mayoría de las disputas entre los criterios diagnósticos se establecen por la inclusión o exclusión de proteinuria como dato de severidad, el establecimiento del término “preeclampsia de aparición temprana” y las cifras tensionales exactas determinar a una paciente con riesgo de enfermedad severa, sin embargo los datos presentados anteriormente son los ampliamente aceptados por la Organización Mundial de la Salud (OMS), Centro Nacional de Excelencia Tecnológica de Salud en México (CENETEC-Salud) y el Congreso Americano de Ginecología y Obstetras (ACOG) 1-3.
Epidemiología
Se ha estimado que complica del 2 al 8% de todos los embarazos globalmente 1,2. En América Latina y regiones del Caribe representa el 26% de las muertes maternas, mientras que en África y Asia sólo corresponde al 9% 1,2. A pesar de que su mortalidad tiende a ser mayor en países en vías de desarrollo, hasta el 16% de la mortalidad materna puede ser atribuido a distintas formas de este espectro de la enfermedad 1,2, con un estimado de 62,000 a 77,000 muertes cada año a nivel mundial 3. En México, se estima que la razón de muertes maternas por esta afección debería de ser 22/100,000 por nacidos vivos1,2. Por cada mujer que muere, se estima que otras 20 pacientes tienen riesgo de sufrir morbilidad severa o discapacidad, además de que aquellas sobrevivientes a casos de severidad tienen un riesgo aumentado a 7 del 20% de padecer hipertensión y microalbuminuria 3.
La tendencia en la población mexicana es con frecuencia tener factores de riesgos mayores para padecer preeclampsia, pues se han descrito una serie variada de características que aumentan las posibilidades de padecer la enfermedad, aunque está bien establecido que la mayoría de los casos se presentarán en mujeres nulíparas sin factores de riesgo evidentes 3,4. Los factores mayores son aquellos que aumentan al 8% las posibilidades de padecer preeclampsia en comparación con aquella mujer sin factor mayor; entre ellos encontramos: historia previa de estado hipertensivo durante gestas previas, embarazo múltiple, hipertensión crónica, diabetes (1,2 o gestacional), enfermedad renal o enfermedad autoinmune previa. Dentro de los factores menores, se definen como aquellos en los cuales es necesario que al menos se encuentren dos de ellos presentes en la misma paciente, para aumentar los riesgos de padecer la enfermedad; entre ellos se mencionan: nuliparidad, índice de masa corporal mayor a 30, historia de preeclampsia en familiar de primer grado, estado socioeconómico bajo, etnia afroamericana, edad materna igual o mayor a 35 años o periodos intergenésicos mayores a 10 años 5,6.
Fisiopatología
La relación exacta de los factores de riesgo y su relación con los factores ambientales todavía no está completamente clara, los estudios sugieren que la base fisiopatológica de la preeclampsia tiene origen múltiple, la teoría más aceptada condiciona un remodelado inadecuado de las arterias espirales en etapas tempranas del embarazo con fallas en el proceso de placentación 1. El flujo inter velloso inicia su proceso de estabilización entre la semana 7-12 de gestación, con la aparición de canales entre las arterias espirales y las lagunas en la pared del blastocisto previamente implantado. La formación adecuada de dichos canales depende de la interacción entre el trofoblasto con las células asesinas naturales NK (Natural Killer) y HLA-E/HLA-G (Human Leukocyte Antigen, Antígeno Leucocitario Humano) del sistema inmunológico de la paciente, serán dichas moléculas encargadas de regular el grado de invasión en el endotelio. Conforme avanza la gestación, los puentes y lagunas se disuelven en el tejido trofoblástico invasor, iniciando desde el centro de implantación a la periferia, lo que asegura que la placenta alcance un suministro sanguíneo suficiente; en caso de que sucediera un crecimiento de la periferia al centro, se comprometería el adecuado gasto placentario, pues el tejido no sería capaz de alcanzar las lagunas sanguíneas en su totalidad, lo que conlleva a atrofia coriónica, placenta pequeña e insuficiente, restricción del crecimiento fetal o preeclampsia 1,7,8.
Al mismo tiempo, las arterias espirales gracias a la interacción previa del sistema inmunológico sufren un proceso denominado “capacitación”, en el cual elevan su diámetro y capacidad de flujo, preparándose para suministrar a los elementos resultantes de la gestación. Dentro de la fisiopatología de la preeclampsia, también se presenta una sobre activación del endotelio generándose una reacción inflamatoria exagerada en comparación con una gestación regular, provocando estrés oxidativo e isquemia placentaria 5,6. La reacción isquémica tiene como resultado secreción de sustancias vasoconstrictoras que predominan sobre el sistema vasodilatador de citoquinas; se secretan factores de crecimiento endotelial (VEGF) y endotelina que elevan la presión arterial como factor defensivo para mantener la perfusión placentaria 5. Existe una sobreexpresión del receptor soluble de endoglobina (sFlt-1), lo cual aumenta la sensibilidad del endotelio de la paciente ante citocinas inflamatorias y vasoconstrictoras 5-7.
Se han establecido modelos que nos permiten mantener una vigilancia estrecha y mantener estrategias preventivas para identificar a las pacientes con riesgo de desarrollar trastornos hipertensivos; muchos de ellos se relacionan con el índice de resistencia vascular y sustancias de producto placentario. De 27 estudios realizados entre el año 2000 y 2016, revisados por Meads y colaboradores, muy pocos han establecido sensibilidad y especificidad arriba de 90 8,9.
Entre los parámetros estudiados se describen: tener un índice de masa corporal mayor a 34 km/m2, niveles elevados de alfa feto proteínas, escotaduras bilaterales en el ultrasonido doppler de las arterias uterinas, niveles elevados de kalikreina en orina y concentraciones plasmáticas de fibronectina; sin embargo, solamente aquellas pruebas relacionadas con kalikreina y los índices de resistencia doppler han sido aptas para seguir siendo estudiadas y ningún solo estudio ha comprobado ser eficiente para ser considerado un estándar de cribado 5,8.
Además, han surgido teorías entre la relación que tienen los radicales libres en el proceso de proliferación endotelial y el papel de ciertos oligoelementos y vitaminas, como es el 2-3 ergocolecalciferol para promover un adecuado proceso de implantación placentaria, potencialmente debido a su papel inmunomodulador y efecto antiinflamatorio 8,9.
Mientras que la fisiopatología de la preeclampsia sigue siendo un tema de controversia y numerosas hipótesis han surgido alrededor de ella, se ha sugerido que los niveles de vitamina D en suero están asociados con riesgo de padecer preeclampsia, especialmente aquella con criterios de severidad 8,10.
Vitamina D, metabolismo y embarazo
La deficiencia de vitamina D se describió por primera vez en el siglo XVII en forma de raquitismo y osteomalacia. La "vitamina", en realidad una hormona esteroide liposoluble, no se descubrió y se inició a describir sus características hasta principios siglo XX 11. Recientemente, la prevalencia hipovitaminosis D ha aumentado provocando un nuevo interés en esta hormona. Además, los estudios de fisiología de vitamina D, sugieren que los efectos de la deficiencia de esta, podría ser mucho más amplio que el raquitismo, incluidas las enfermedades cardiovasculares, el cáncer, la diabetes y complicaciones del embarazo 7,10,
Las concentraciones regulares de vitamina D se encuentran entre 32 a 80 ng/ml, considerando los valores menores a 32 ng/ml como hipovitaminosis franca. La evidencia indica que la hipovitaminosis se asocia a casos de infertilidad, preeclampsia, diabetes gestacional y restricción del crecimiento intrauterino 8,10.12.
Durante el embarazo, los niveles séricos de 1,25 (OH) D aumentan hasta 2 veces a partir de las 10-12 semanas de gestación y alcanzando un máximo en el tercer trimestre. No está claro si los niveles de 25 (OH) D aumentan durante el embarazo 13; sin embargo, dado un aumento en el activo forma de vitamina D, las mujeres embarazadas probablemente tengan una mayor exposición celular a vitamina D durante el segundo y tercer trimestres que sugieren un papel para vitamina D en el bienestar obstétrico 8,10.
La determinación de 25 (OH) D es la medida estándar clínica y de investigación del estado de la vitamina D. Sin embargo, dado la complejidad del sistema de la vitamina D, no está claro si los niveles de 25 (OH) D tienen las mismas implicaciones clínicas en todas las mujeres o en todas las etapas del embarazo 14,15. Por ejemplo, aunque los niveles de 25 (OH) D fueron más bajos entre las mujeres negras que las caucásicas en un estudio, sus niveles de Proteína ligadora de vitamina D también fueron más bajos, lo que resultó en niveles equivalentes de 1,25 (OH) D libre calculada 10,15,16.
Algunos investigadores sugieren medir los niveles de la hormona paratiroidea como marcador biológico de deficiencia de vitamina D. Sin embargo, los niveles de hormona paratiroidea tienen estado inconsistentemente asociado con 25 (OH) D niveles de mujeres embarazadas17. Esto puede ser debido a un efecto umbral: los niveles de hormona paratiroidea solo aumentan cuando 25 (OH) D es muy bajo (por ejemplo, menor 20ng/lt)18. Sin embargo, dicho umbral no ha sido identificado 13,19,20.
Según el informe del Instituto de Medicina de 2010 (IOM), 12ng / L (30nmol / L) de 25 (OH) D es el punto debajo del cual "las personas están en riesgo de deficiencia ósea". "Algunos, pero no todos son potencialmente “en riesgo” con niveles inferiores a 20 ng / L (50 nmol / L)18,20.
Sin embargo, el Colegio Americano de Ginecología y Obstetricia (ACOG) en el 2011, reveló su boletín de práctica clínica "Vitamina D: detección y suplementación" definiendo la deficiencia como niveles de 25 (OH) D inferiores a 20 ng / L (50 nmol / L) 20,21.
Estos puntos de corte y otros se utilizan para definir la deficiencia de vitamina D en diferentes estudios; por lo tanto, niveles de "deficiencia de vitamina D" en varios de las poblaciones no se pueden comparar directamente, pues depende de los parámetros o clasificaciones que usaron para definir la hipovitaminosis 22,23.
Finalmente, hay múltiples ensayos 25 (OH) D disponibles comercialmente, que no producen resultados idénticos, esto hace que la comparación de datos de múltiples estudios sea más complicada. Históricamente, 25 (OH) D se ha medido con inmunoensayos de unión a proteínas, pero la cromatografía con espectroscopía de masas en tándem es la tecnología más precisa 16,23,24.

Usando los puntos de corte de la OMS el 7% de las mujeres embarazadas o lactantes de EE. UU. En este país la base de datos estaba en riesgo de deficiencia de vitamina D (<12ng / L) y un 21% adicional estaba en riesgo de padecer deficiencia en 2006 (<20ng / L). Utilizando los niveles de 20ng/lt como punto de corte, sin embargo, estudios de todo el mundo muestran altos porcentajes de deficiencia de vitamina D, durante el embarazo: el 100% de los inmigrantes somalíes en Suecia, 96% de mujeres indias urbanas, 89% de mujeres japonesas urbanas, 69% de mujeres urbanas Urrutia , mujeres chinas, 54.7% de mujeres del Reino Unido en el primer trimestre, 50% de adolescentes de Baltimore, 46% de mujeres trabajadoras de Pakistán, el 41% de las mujeres de Carolina del Sur, el 41% de las mujeres estadounidenses en un base de datos nacional, 35-46% de mujeres australianas, 24% de mujeres de Canadá occidental, 20% de las mujeres latinas (México, Guatemala, Argentina) y 7% de mujeres de Carolina del Norte 7, 15, 16, 22, 24.
Los factores de riesgo no modificables asociados constantemente con la deficiencia son la temporada de invierno y pigmentación de la piel más oscura. Los factores de riesgo modificables incluyen menos exposición al sol (geografía o relacionado con la ropa), menor ingesta dietética de alimentos con alto contenido de vitamina D o suplementos de vitamina D, y mayor IMC. Desafortunadamente, no todos los estudios controlan los mismos factores de riesgo o miden los factores de riesgo de manera estándar, por lo tanto, es difícil comparar resultados directamente entre poblaciones 10.
Vitamina D en la patogénesis de la preeclampsia. Evidencia
La vitamina D juega un papel fundamental en la homeostasis del calcio y fósforo, sin embargo, quizá también desarrolle un papel fundamental, pues se ha asociado niveles mayores de interleucina 6 (IL-6) en pacientes con hipovitaminosis D, lo que se asocia a procesos inflamatorios de mayor intensidad7,8,10. El trofoblasto humano tiene la capacidad de responder a la forma activa de la vitamina D (1-25-OH-2D), regulada por la actividad enzimática de la 1 A hidroxilasa, y la degradación por parte 24 A hidroxilasa, estudios recientes comprueban que la vitamina D tiene acción sobre los receptores de la 24 A hidroxilasa, inhibiendo mRNA de transcripción, aumentado la vida media de la vitamina e inhibiendo la producción de citoquinas proinflamatorias (TNFA, IFN gamma e IL6), apoyando la hipótesis sobre el daño endotelial de la preeclampsia 10.
En un estudio de cohortes realizado por la Universidad de Texas y colaboradores en 2016, en el que se examinaron 100 pacientes con preeclampsia y 100 controles normotensas, se realizaron comparaciones entre los niveles de vitamina D y niveles de IL-6, los resultados arrojaron concentraciones de 25 OH vitamina D de 49.4 mmol +- 22 mmol/lt más niveles de IL-6 de 2 pg/ml en pacientes sin patología hipertensiva, mientras que las pacientes con preeclampsia tenían valores de 42 mmol +- 17 mmol/ltmás niveles de IL-6 de 4 pg/ml 8. Con dichos resultados se concluía que los niveles de interleucina y vitamina D eran factores de riesgo independientes para padecer preeclampsia, pero no tenían suficiente valor estadístico para apoyar la hipótesis que la vitamina D podía alterar la activación de factores de inflamación, como lo cual está comprobado con los niveles de IL-6 9,10.
Durante el 2010, Robinson organizó un estudio de casos y controles anidado a una cohorte, siguiendo a pacientes con <16 semanas de gestación hasta finalizar el embarazo, y correlacionó el estado materno de vitamina D, encontrando que los niveles de 25 OH D eran menores en pacientes que desarrollaron preeclampsia de manera temprana comparado con los controles 8,11,25.
De manera similar, Haugen y colaboradores durante el 2009 recolectaron datos de más de 23,425 pacientes embarazadas en hospitales de Nueva Zelanda, calculando la ingesta de vitamina D a través de instrumentos tipo cuestionario, encontraron que aquellas pacientes que tenían una suplementación de vitamina D adicional a la dieta, tenían 27% menos posibilidades de desarrollar trastornos hipertensivos relacionados con la gestación. Los resultados anteriores fueron respaldados por la Universidad de Baker en 2011, quienes condujeron un estudio similar de 3992 pacientes embarazadas, encontraron asociación de niveles bajos de vitamina D con padecer preeclampsia severa (OR 5.41) 8,11,25.
Durante el 2018, la Asociación de Ginecología y Obstetricia de Taiwan, realizó una revisión sistemática y metaanálisis de 25 artículos, acerca de la asociación de ambos niveles de 25-hidroxi vitamina D (25-OHD)(enfoque paramétrico) y deficiencia de 25-OHD (enfoque no paramétrico) con preeclampsia. También, para la parte paramétrica, se utilizó el modelo de curva de características operativas del receptor (ROC). Los resultados que arrojaron según FORESTPLOT fueron que los niveles más bajos de 25-OHD se asociaron significativamente con el riesgo de preeclampsia (P fijo y aleatorio <0,001), además la deficiencia de vitamina D (25-OHD <20 ng /ml) se asoció significativamente con el riesgo de preeclampsia (P fijo <0,0001; P aleatorio ¼ 0,0029; fijo OR ¼ 1,33; aleatorio OR ¼ 1.54). Con base en los resultados de la curva ROC, encontramos 2 cortes de 10.60 y 20.05 ng / ml. Concluyendo que las mujeres con deficiencia de vitamina D en el corte de 20 ng / ml tienen más riesgo de preeclampsia y que la asociación mencionada puede ser específica hasta un 90% con un límite de 10,60 ng / ml. Lo que sugiere necesario tratar la deficiencia de vitamina D durante el embarazo 11,13, 26.
Suplementación en hipovitaminosis D y embarazo
La suplementación con vitamina D probablemente aumenta los niveles de 25 (OH) D. Las mujeres suplementadas tenían menos vitamina D deficiencia en 3 grandes cohortes bien controladas (N = 1539), una tendencia similar en una calidad más pobre estudio (n=201) y ninguna diferencia en un estudio con una baja tasa general de suplementación (n= 559). Los ensayos clínicos referentes a la suplementación de vitamina D han mostrado consistentemente éxito en el aumento de los niveles de 25 (OH) D en mujeres embarazadas y neonatos, aunque con dosis variables de 25 (OH) D. Solo se informa un ensayo negativo en la literatura, y la dosis fue de 400 UI 11, 14, 18, 22, 24. Todas las otras dosis fueron más altas, con un rango de 800-1000 UI / día a 100,000-200,000 UI administradas como dosis únicas. A pesar de los aumentos con la suplementación, los niveles de 25 (OH) D se mantuvieron bajos en la mayoría de los estudios 22,24.
Un reciente ensayo aleatorizado, doble ciego controlado con placebo fue llevado a cabo en mujeres embarazadas de Carolina del Sur. Los esquemas de tratamiento fueron 2000 UI VD diariamente más estándar vitaminas prenatales y 4000 UI VD diarias más vitaminas prenatales estándar en comparación con un esquema de placebo que consiste en una píldora de placebo más vitaminas prenatales estándar. El nivel medio de vitamina D medido a las 36 semanas fue de 79 nmol / L para el grupo de control, 105 para el grupo de 2000 UI, y 119 para el grupo de 4000 UI. Esta diferencia fue estadísticamente significativa (p<0,0001); sin embargo, los niveles fueron más altos que la mayoría de los otros ensayos, incluso en el grupo placebo. Desafortunadamente, casi el 30% de los participantes fueron excluidos del análisis debido a la "mala adherencia"10,24. Aunque la intervención disminuyó la "deficiencia de vitamina D", no se encontraron diferencias en perinatales significativas que pudieran justificar el uso universal de vitamina D en el esquema prenatal 24,25,26.
En su informe de 2011, OMS recomendó 600 UI por día de 25 (OH) D para mujeres embarazadas específicamente para apoyar el metabolismo óseo y no más de 4000 UI por día para evitar la hipercalcemia. El ACOG respalda estas recomendaciones y propone 1000-2000 UI por día de 25 (OH) D cuando se identifica una deficiencia (<20ng / ml). La ingesta dietética puede ser otra vía para aumentar los niveles de VD. La deficiencia de vitamina D no es tan alta como esperado en países en latitudes más altas (menos exposición al sol) como el norte de Europa, Estados Unidos y Canadá. No hay ensayos clínicos sobre el aumento o deficiencia de vitamina D relacionada con cambios dietéticos 6,10,24.
En un estudio alemán, todas las mujeres embarazadas con hipertensión que asistieron al Hospital Central de Berlín fueron suplementadas con vitamina D dando 4 veces 400,000 UI (10 mg) 22. El autor informó que ninguna de las 88 madres que respondieron al tratamiento con vitamina D con la presión arterial reducida desarrolló preeclampsia, mientras que en aquellos sin reacción inicial la incidencia fue del 44% (14 de 32 mujeres). En ensayos que incluyen un grupo de control, la vitamina D se ha administrado en combinación con otros suplementos dietéticos, más comúnmente calcio. En los primeros estudios publicados en 1937, con tratamiento de vitamina D (450 UI / día) con calcio (168 mg / día) y vitamina A (11,000 UI / d) no se encontró una asociación significativa con el riesgo de preeclampsia. En otro estudio publicado en la revista europea de ginecología y reproducción 23, 400 mujeres embarazadas fueron asignados aleatoriamente (método no especificado) para recibir vitamina D (1200 UI / d) con calcio (375mg / d) o a un grupo control que no recibió suplementos 6,7,22,23. Después de 8 a 10 semanas de suplementación, sangre la presión se redujo significativamente en el grupo tratado, y hubo una sugerencia de que una proporción menor de suplementado que las mujeres control desarrollaron preeclampsia (6% en comparación con el 9%) 9,23.
El estudio realizado por la Liga de la Salud de las Personas en Londres. Utilizó un estudio aleatorizado y asignó 2,510 mujeres para recibir una combinación de aceite de bacalao, vitaminas y minerales (que contiene 900 UI de vitamina D y 260 mg de calcio / día, entre otros nutrientes); El grupo control conformado por 2,512 mujeres no recibió ningún tratamiento. Los resultados informaron que el desarrollo de preeclampsia se redujo en un 31% (IC 95% 11% –47%) en mujeres tratadas comparadas con controles 5,20,21. Este hallazgo se ha utilizado posteriormente para apoyar las hipótesis que sugieren un efecto beneficioso de calcio y aceite de pescado en preeclampsia20,21.
Sin embargo, el pescado y el aceite purificado de vitamina D no pudo demostrar efecto beneficioso sobre el riesgo de preeclampsia. En un caso más reciente de ensayo cuidadosamente diseñado (aleatorizado, doble ciego, controlado con placebo), los estudios que usaron suplementos de calcio sin vitamina D han arrojado resultados inconsistentes 3,5,20,21. Resultados de un meta-análisis de la información de seis ensayos aleatorios controlados con placebo sugirió que la suplementación con calcio reduce el riesgo de desarrollar preeclampsia, pero solo en mujeres que tiene una baja ingesta de calcio y un alto riesgo de desarrollar problemas hipertensivos durante el embarazo. El reglamento del metabolismo del calcio es el clásico fisiológico en función de 1,25 (OH) 2D, y la deficiencia secundaria de vitamina D puede resultar de una ingesta inadecuada de calcio en la dieta 20,22.
Otros mecanismos subyacentes a la asociación entre los suplementos de calcio y el riesgo de preeclampsia no son bien establecidos, y uno puede especular que aumentó la disponibilidad de 1,25 (OH) 2D puede haber mejorado la inmunidad regulación después de la corrección de calcio inadecuado ingesta, contribuyendo así a los beneficios observados 11,13,22. En contraste con estudios anteriormente mencionados, se han realizado protocolos de casos y controles de 150 embarazos con producto único que desarrollaron preeclampsia en contra de 100 embarazos controles normotensos, y se investigaron los niveles de vitamina D durante el primer trimestre (11-13 semanas de gestación), en busca de asociar las alteraciones de vitamina D con estados hipertensivos; sin embargo, dicho estudio indicó que los niveles séricos de vitamina D no cambian en pacientes que subsecuentemente desarrollen preeclampsia8,11,13.
Explicando la biodisponibilidad y metabolismo de la vitamina D, podemos entender la plausibilidad biológica que tiene este producto con la preeclampsia y trastornos placentarios. La podemos encontrar de dos formas, vitamina D2 y vitamina D3, la forma D3 corresponde al 90% de la forma circulante y corresponde con la forma activa. La mayor cantidad de D3 deriva de la síntesis cutánea a partir de la exposición solar de 7-dehidrocolesterol, mientras que la forma D2 deriva principalmente de componentes dietéticos (aceites, cereales, leguminosas y huevo), aunque dicha cantidad representa <10% comparada con la síntesis endógena 10,11,13.
La exposición al sol se mide por una variedad de métodos: latitud, estación, cobertura de la piel con ropa, pigmentación de la piel y etnia. Sin embargo, en todos los estudios, hay más exposición al sol significativamente asociado con el aumento de los niveles de vitamina D. La exposición al sol puede aumentar en mayor cantidad los niveles de vitamina D en comparación con su ingesta No existen ensayos de exposición solar relacionados con el aumento de los niveles de vitamina D en el embarazo. La forma de vitamina D2 es inactiva y deben pasar el proceso de activación mitocondrial por secuencias mitocondriales para convertirse en calcidiol. La vitamina D viaja unida a la proteína especifica de vitamina D, llega al hígado donde es convertida por el sistema mitocondrial CYP24A1 y con ayuda de la 24-A-hidroxilasa en 25 (OH) D, esta forma posteriormente pasa por el sistema renal para convertirse con ayuda de la 1-A hidroxilasa en la forma biológicamente activa, denominada 1,25 dihidroxivitamina D 13,14,27.
Vitamina D y placenta
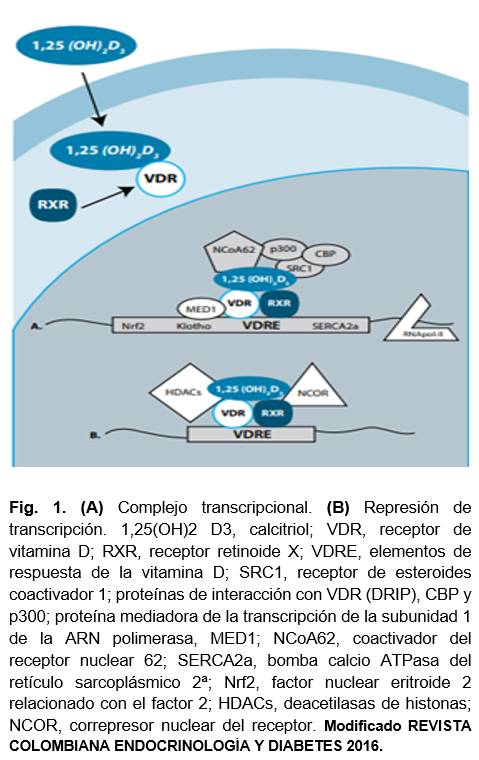
La forma activa de la vitamina D juega un papel regulador el proceso de placentación, de manera regular, llega hasta su receptor de vitamina D (VDR Vitamin D Receptor) figura 1, el cual se expresa en el trofoblasto y tejido decidual dependiendo de la carga genética y síntesis endógena de vitamina D de la paciente. Cuando existe una disminución de la carga de VDR, el trofoblasto empieza a crecer e invadir de forma desorganizada acompañándose de niveles elevados de gonadotropina coriónica humana; sin embargo, la invasión no se vuelve funcional, pues la desorganización ocasiona que no se alcancen los espacios lacunares de forma correcta, comprometiendo el aporte arterial/oxígeno de la unidad fetoplacentaria12,14. El crecimiento poco funcional del trofoblasto, tiene como consecuencia una aceleración en el proceso de apoptosis, por dos razones fundamentales: la primera es la inducción de muerte celular programada por detección del sistema inmunológico ante el proceso de placentación anómalo y la segunda es la falta de aporte nutrimental al trofoblasto invasor. Con estas acciones cae la expresión del factor de crecimiento tipo 3 (TGFB3) y la placenta concluye su formación, pero de manera insuficiente, contribuyendo a la patogenia de la preeclampsia y la restricción del crecimiento intrauterino 5,7,13.
En embarazos regulares, encontramos concentraciones circulantes de 1,25 (OH) 2D son elevados desde el primer trimestre. Aparece un aumento progresivo durante la gestación y en el tercer trimestre 1,25 (OH) 2D aumenta más de dos veces en comparación con los niveles posparto o el grupo control que corresponde a las mujeres no embarazadas. La producción local de 1,25 (OH) 2D puede ser especialmente importante para el aumento en las etapas más tempranas del embarazo, se ha observado como la actividad de la 1-hidroxilasa en la decidua y placenta es más alta los primeros dos trimestres. Esta activación local de vitamina D se ha sugerido que influye en la implantación, en parte a través de los efectos inmunomoduladores de 1,25 (OH) 2D y en parte por la regulación de genes diana asociados con implantación. Los efectos sobre la implantación podrían explicar el aumento temprano en los niveles 2D de 1,25 (OH), ya que la demanda para cumplir con los mayores requisitos de calcio para la mineralización del esqueleto fetal solo debería aumentar en el embarazo tardío 7,8,11,26.
En comparación con los embarazos normales, la preeclampsia es caracterizada por cambios marcados en la vitamina D y el metabolismo del calcio. La excreción urinaria de calcio se reduce, y la hipocalciuria incluso ha sido sugerida como herramienta de diagnóstico para la detección de preeclampsia, sin obtener resultados alentadores en los ensayos de pruebas diagnósticas. Se ha propuesto la hipocalciuria es consecuencia de la disminución de la eficiencia de la absorción intestinal de calcio, causada por bajos niveles de 1,25 (OH) circulante 9,11,26.
Existe una reducción bien informada en los niveles de 1,25 (OH) 2D circulantes en pacientes preeclampticas en comparación con embarazadas normotensas o con hipertensión crónica controles 21,22,27, que pueden deberse a una perturbación en la hidroxilación local 1 dentro de la placenta. Esta proposición está respaldada por evidencia de una reducción de la actividad de 1-hidroxilasa en placentas obtenidas de mujeres que sufren de preeclampsia con o sin datos de severidad.
Hasta la fecha, hay información insuficiente sobre la actividad de 1-hidroxilasa o niveles de 1,25 (OH) 2D de mujeres preeclampticas antes del inicio de la enfermedad para confirmar esta hipótesis 15,24,26.
La inmunología reproductiva tiene la convicción de que el embarazo es un tipo de trasplante llamado semi-aloinjerto. La tolerancia inmunológica inducida por las células NK impide el rechazo de este trasplante. En un embarazo exitoso, el sistema inmunológico no consiste solamente en lograr que la cavidad endometrial no rechace el embrión, sino que también protege al sistema de la gestación de futuros agresores; se secretan factores adhesivos y angiogénicos que permiten continuar el embarazo 4,13,15.
Otros factores inmunológicos íntimamente relacionados son el balance hormonal; tomando como ejemplo la relación estrógeno/progesterona, regulada con el equilibrio entre los linfocitos CD4+ colaboradores, que se encargan de señalar y permitir el paso del trofoblasto al tejido endotelial 13,15.
Las células T reguladoras (T reg) están involucradas en la fisiología del embarazo 15. Las T regs (CD4þ y CD25þ) juegan un papel fundamental en la modulación placentaria. La proliferación y diferenciación de estos linfocitos están controlados por el gen forkhead box P3 (FOXP3) 5,7,13. La expresión de FOXP3 actúa estimulando el factor de crecimiento beta (TGF-b). Aparte de TGF-b, este gen se ve afectado por la vitamina D3. Por lo tanto, el receptor de vitamina D (VDR) será otro gen involucrado en preeclampsia y otras complicaciones del embarazo 3,11,15.
Parece que la deficiencia de vitamina D resulta en una baja regulación de las células Treg, teniendo como consecuencia fallo en la señalización epitelio-linfocito 9,14,22. Como conclusión, en estudios recientes, no hubo diferencia en el cambio de los niveles 2D de suero materno 1,25 (OH) entre las mujeres preeclampticas y el grupo control de mujeres embarazadas sin enfermedad, los autores sugirieron que las diferencias en las determinaciones de 1,25 (OH) 2D, que se observa comúnmente en la preeclampsia, puede ser un fenómeno secundario al daño renal inducido por la enfermedad en lugar de un fenómeno primario 9,13,24. Sin embargo, los niveles de 1,25 (OH) 2D en este estudio también fue comparable entre los grupos en el tercer trimestre (es decir, después del inicio de la enfermedad), lo que sugiere que los niveles séricos de 1,25 (OH) 2D pueden no haber reflejado adecuadamente la hidroxilación 1 local. Una observación interesante que puede sugerir una asociación entre la vitamina D y la preeclampsia son los aumentos en los niveles de 1,25 (OH) 2D que acompaña el tratamiento con sulfato de magnesio en un ensayo en pacientes con preeclampsia 12,11,21,24.
La terapia con sulfato de magnesio es ampliamente utilizada para el tratamiento de convulsiones en el manejo de la preeclampsia, y podría especularse que los aumentos observados en 1,25 (OH) 2D podrían contribuir o explicar la mejora en los síntomas 9,11,26.
Tratando de encontrar significancia clínica y futuras referencias, se plantea que si las perturbaciones en el metabolismo placentario de la vitamina D, como la disminución en su síntesis y la expresión de su receptor VDR realmente contribuyen a la patología del estado hipertensivo y restricción del crecimiento, esos estados podrían ser prevenidos con la implementación de suplementos de vitamina D dentro del embarazo, plantear pruebas de tamizaje dentro del control prenatal para hipovitaminosis D o bien; diseñar un modelo de predicción de preeclampsia en base los niveles séricos de 25 OH D de la paciente o incluso añadir a los algoritmos de predicción ya existentes. La eficacia de dicha suplementación obviamente debería ser evaluada en estudios metodológicos más robustos, pero debería ser prometedor, ya que existen pocos elementos que nos permiten mejorar directamente el proceso de placentación, lo cual se cree, es la base de la patología hipertensiva de la gestante 9,11,26,28.
La Vitamina D y su receptor son activos en la placenta humana y la modulación inmunológica, lo que sugiere un papel causal de la deficiencia de vitamina D y preeclampsia. Esta hipótesis ha sido apoyada por numerosos estudios de cohorte de mujeres expuestas y no expuestas a suplementos de vitamina D mencionados anteriormente, tomando como ejemplo un ensayo clínico controlado de vitamina D suplementos y un ECA de suplementos de aceite de pescado; aquellas mujeres expuestas a VD desarrolló menos preeclampsia 1,5,6,20.
La hipertensión en el embarazo es más común en invierno o en las estaciones lluviosas cuando la deficiencia de VD también es mayor, los niveles más altos de VD se han asociado constantemente con una menor incidencia de preeclampsia y valores bajos de presión arterial cuando se mide en el momento del diagnóstico o el parto 3,8,22. Por lo tanto, varios grupos han tratado de determinar los niveles de 25 (OH) D medidos antes del diagnóstico de preeclampsia están asociados con el diagnóstico final del estado hipertensivo 22.
Los resultados de estos estudios de control de casos en su mayoría son mixtos. Probablemente hay varias razones por esta inconsistencia: tamaños de muestra pequeños que conducen a una potencia insuficiente, diferentes grupos de control (algunos estudios excluidos "embarazos complicados"), heterogeneidad racial / étnica y socioeconómica de poblaciones estudiadas, diferentes métodos para medir la concentración de 25 (OH) D hidroxivitamina, diferentes puntos de corte para la deficiencia de vitamina D y variables de confusión atribuible a la ingesta dietética y exposición solar variable28.
En general, los resultados sugieren que los niveles de 25 (OH) D a principios el embarazo puede estar asociado con preeclampsia posterior solo en subgrupos específicos: mujeres con niveles muy bajos de 25 (OH) D (<13.2 ng / L) o mujeres afroamericanas 3,4,22,28.
CONCLUSIONES
La evidencia mostrada sugiere que la vitamina D puede desempeñar un papel importante en la patogénesis de la preeclampsia y que en teoría una adecuada ingesta y el estado durante el embarazo contribuirían a la prevención y el manejo de esta grave afección. Esta hipótesis se basa en un vínculo inmunológico entre el sistema hormonal de vitamina D y la preeclampsia, posiblemente actuando a través de la regulación del equilibrio entre respuestas de citocinas de tipo Th1 y Th2 durante el embarazo, las cuales tienen la función de regular los procesos inflamatorios y de neovascularización 2,6,8.
Como se revisó anteriormente, la evidencia que sugiere una asociación entre la vitamina D y la preeclampsia proviene de muchas líneas de investigación que van desde correlaciones y experimentos in vitro con observaciones clínicas y algunos estudios de intervención relacionados en pacientes preeclampticas. Sin embargo, hasta la fecha, no existen ensayos clínicos bien controlados, y la hipótesis actual se basa principalmente sobre ideas que todavía están bajo actividad de investigación. Por ejemplo, gran parte de la evidencia se basan los efectos de 1,25 (OH) 2D en el sistema inmunológico en experimentos in vitro y los efectos in vivo, que incluso puede ser específico de un órgano y deben aclararse 25,26.
Además, existe un fuerte apoyo a la idea de que la inadaptación inmune contribuye a la etiología de preeclampsia, pero los procesos patogénicos exactos y la posibilidad de varios subtipos de preeclampsia no han sido establecidos 18.
Recientemente, el paradigma Th1 / Th2 ha sido criticado, y es evidente que el original la hipótesis es una gran simplificación de lo subyacente procesos inmunológicos 17,18.
Una de las preguntas importantes sin respuesta relevantes a la hipótesis actual es la falta de acuerdo sobre los niveles óptimos de 25 (OH) D o de ingesta de vitamina D para personas sanas que carecen de una exposición adecuada a la luz del sol, esto también para las mujeres embarazadas, para quienes la recomendación actual en los Estados Unidos es 200 IU/d, mientras que en Gran Bretaña y Latinoamérica no hay recomendación 1,2,5,19,21.
La deficiencia de D en sí misma presenta un dilema, como el citado bajo los límites para el suero "normal" 25 (OH) D varían entre 5 y 45 nmol/L. Para la prevención de la osteoporosis, por ejemplo, un grupo de expertos internacionales ha sugerido recientemente que los niveles de 25 (OH) D deben exceder 72 nmol / L. Donde la producción de vitamina D inducida por el sol es limitada, la dieta requerida para alcanzar estos niveles será de 1000 UI / d o superior 18,19.
Además, se ha sugerido que los niveles de 25 (OH) D necesarios para una regulación inmune óptima puede ser mayor que los necesarios para la regulación del metabolismo del calcio. Por lo tanto, los efectos beneficiosos de la vitamina D sobre el riesgo de preeclampsia pueden requerir más vitamina D de lo que se necesita para asegurar normocalcemia ósea fetal 18,19.
Se requiere de la investigación básica y ensayos clínicos para dilucidar el papel de la ingesta de vitamina D y el estado en la prevención o tratamiento de preeclampsia. Existe una necesidad para ensayos clínicos bien controlados con vitamina D, en el que la profilaxis debe administrarse preferiblemente en combinación con calcio suplementario (o estandarizada ingesta dietética adecuada). Sin embargo, los esfuerzos inmediatos para minimizar el riesgo de deficiencia de vitamina D en embarazadas las mujeres son aún más urgentes. Dado nuestro conocimiento actual sobre los importantes a corto y largo plazo efectos sobre la salud de la vitamina D. Es indiscutible que prevenir la hipovitaminosis D durante el embarazo proporcionar beneficios de por vida tanto a la madre y al producto de la gestación en vida extrauterina 1,2,3,19.
Referencias