Rev Med UAS
Vol. 12: No. 4. Octubre-Diciembre 2022
ISSN 2007-8013
Víctor Fernando Muñoz-Estrada1, Ángel Ignacio Osuna-Leal2, Lourdes Estrada-Alpízar2*
* Correspondencia: Lourdes Estrada-Alpízar
Eustaquio Buelna #91, Colonia Tierra Blanca. CP 80030, Culiacán, Sinaloa
Teléfono: (667) 7137978. Correo electrónico: luestalp3@hotmail.com
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v12.n4.003
Texto Completo PDFRecibido 04 de marzo 2022, aceptado 02 de septiembre 2022
RESUMEN
Objetivo. Identificar los aspectos clínicos del HZ en niños. Material y métodos. Se realizó una revisión de pacien-tes menores de 16 años con diagnóstico clínico de HZ en el periodo de 2010 a 2020. Resultados. De los 90 pacientes, 55% fueron hombres, la edad más frecuente fue entre 5 a 9 años y 33.5% tuvieron varicela de los 4 a 5 años.
Se determinó al 100% inmunocompetentes, la topografía más habitual fue tronco en 60%, con predominio de la me-támera T1, el 77.7% se presentó morfológicamente como eritema y vesículas, la duración promedio fue de 4 días y el 56% presentó dolor. --- Conclusiones. En este estudio se encontró que el herpes zoster se presentó más en varones inmunocompetentes de 5 a 9 años de edad, en tronco, a nivel de T1, como eritema y vesículas, acompañada de dolor y fiebre.
Palabras clave. Herpes Zoster, Varicela, Metámera.
ABSTRACT
Objective. To determine the clinical aspects of HZ in children. Material and methods. A review of patients under 16 years of age with clinical diagnosis of HZ was carried out in the period from 2010 to 2020. Results. Of the 90 pacients, 55% were men, the most frequent age was between 5 to 9 years and 33.5% had chickenpox from 4 to 5 years.
It was determined 100% inmunocompetent, the most common topography was trunk in 60% with presence of the T1 metamer, 77.7% presented morphologically as erythema and vesicles, with an average duration of 4 days and pain in 56%. --- Conclusions. Herpes zoster affects 5 to 9 years old males, immunocompetent, and it is characterized by erythema, vesicles on the trunk, on T1 territory, associated with pain and fever.
Keywords. Herpes Zoster, Chickenpox, Metamer.
INTRODUCCIÓN
El Herpes Zoster (HZ) es una enfermedad infecciosa, neurocutánea caracterizada por presencia de vesículas agrupadas en racimos localizadas en una metámera; se produce por reinfección o reactivación del virus varicela-zoster (VVZ), desde las raíces sensitivas de ganglios dorsales1,2,3,4. Otros nombres de esta enfermedad son “fuego de San Antonio”, “fuego sagrado” y “culebrilla”5. En 1952 Weller logró aislar el virus VVZ y en 1965 Hope-Simpson describió la fisiopatología y las manifestaciones clínicas de HZ6,7.
Es una enfermedad con distribución mundial, en Europa la incidencia es de 3 casos por 1,000 habitantes y aumenta a 10 casos por 1,000 habitantes en mayores de 80 años2. Afecta por igual a ambos sexos, es poco frecuente en la niñez, tiene una incidencia en menores de nueve años de 0.74 por 1000 habitantes y se asocia a inmunosupresión en la mayoría de los casos. El riesgo estimado de padecer HZ posterior a la primoinfección por VVZ es de 10 a 20%, aumentando con la edad, por lo que su incidencia es mayor en la vejez6,8,9. En Estados Unidos la incidencia es de 27.4 a 93.3 por 100,000 habitantes y antes de la introducción de la vacuna, en menores de 19 años era de 40-220 por cada 100,000 personas año10,11. En niños sanos corresponde al 1% de total de casos, pero se ha visto un aumento en su incidencia, incluso en pacientes aparentemente sanos12. Los factores de riesgo para HZ documentados son edad avanzada, Diabetes Mellitus descontrolada, tratamiento inmunosupresor, virus de inmunodeficiencia humana (VIH) y enfermedades neoplásicas6,13. En niños se asocia a enfermedad oncológica subyacente, diagnosticándose únicamente en 3% de los casos14. Las neoplasias infantiles asociadas son leucemia y linfoma de Hodgkin, y la aparición de HZ se presenta como consecuencia al tratamiento inmunosupresor de éstas4,15. Otros factores de riesgo en estudio son raza caucásica, sexo femenino, susceptibilidad genética, estrés psicológico y traumatismos16,17. En la edad pediátrica se distinguen 3 factores de riesgo muy importantes: el inmunocompromiso, el desarrollo de varicela en la madre durante el segundo trimestre del embarazo y padecer varicela durante el primer año de vida8,14. El síndrome de varicela congénita es infrecuente; sin embargo, confiere mayor riesgo de HZ en la infancia18. La incidencia en los pacientes que padecieron varicela durante el primer año de vida es de 4.5 por cada 1,000 personas-año, el riesgo relativo de HZ es de 2.8-20.9 en estos pacientes; debido al paso de anticuerpos maternos y la falta de madurez del sistema inmune, que resulta en una inmunidad deficiente14,15.
El agente etiológico pertenece a la familia herpesviridae, un ADN virus de doble cadena cubierto por una cápside icosaédrica y una capa de glicoproteínas con diámetro de 200 nm4,6. La primoinfección, manifestada como varicela, inicia su patogenia con la entrada del virus por la mucosa de las vías respiratorias superiores o conjuntiva, se replica inicialmente en los ganglios linfáticos regionales dando lugar a la viremia primaria, posteriormente se disemina vía hematógena, alcanza el sistema retículo-endotelial replicándose y posteriormente establece una viremia secundaria, con invasión a piel y axones sensitivos, las células mononucleares infectadas transportan al virus a los ganglios dorsales de la médula espinal donde la inmunidad celular detiene la replicación viral, instaurando el virus como latente6,19. La infección primaria confiere inmunidad humoral, la prevalencia de anticuerpos frente al VVZ es >80% y >90% en edad de 5-9 años y 10-14 años respectivamente20. La reactivación del VVZ latente da lugar al HZ, el cual se desarrolla cuando hay descenso de los niveles de linfocitos T, asociado a inmunosupresión y los factores de riesgo mencionados. En el ganglio neural la replicación viral genera adenitis, viremia y necrosis neuronal, dañándose los nociceptores y causando neuralgia6.
El cuadro clínico se distingue por la presencia de disestesias, parestesias y una dermatosis característica localizada unilateralmente en el área sensitiva correspondiente al ganglio dorsal afectado, generalmente afecta una sola metámera y no rebasa la línea media del cuerpo, pero puede haber afección de 3 metámeras hasta en un 20%. Suele cursar con pródromos 4 a 14 días previo a la aparición de la dermatosis y su instauración puede iniciar con la presencia de parestesias, prurito o dolor, localizado en la trayectoria de un nervio sensitivo; siendo más frecuente la afección de los nervios intercostales (53%). En 12 a 48 horas aparecen vesículas de 2 a 3 mm de diámetro que se agrupan en racimos, sobre una base eritematosa, en los siguientes 3 a 4 días las vesículas se umbilican, desecan o se transforman en pústulas; que finalmente evolucionan a ulceraciones y costras melicéricas en un lapso de 7 a 10 días. Pueden coexistir diferentes lesiones al mismo tiempo, presentar síntomas generales y adenopatía regional6,8,21. En el niño sano suele tener un curso benigno con duración menor a 3 semanas8,14,15.
La principal complicación es la neuralgia post-herpética, se presenta en 10-20% de los casos y es rara en pacientes menores de 40 años2. En los niños, a diferencia del adulto, es infrecuente la presencia de dolor y la neuralgia post-herpética es excepcional; sin embargo, se ha reportado que la mayoría cursa con prurito en la metámera afectada e incluso pueden presentar prurito postherpético22. Los nervios más afectados son los cervicales y craneales23. Otras complicaciones son sobreinfección bacteriana y compromiso ocular, el síndrome de Ramsay-Hunt es poco frecuente6,8,15,24. En niños inmunocompetentes el HZ no suele ser inocuo; sin embargo, en Japón se reportaron 2 casos de meningitis en pacientes inmunocompetentes, en Alemania concluyen que 1 de cada 250 niños sanos con HZ se hospitalizan debido a complicaciones y en la India se reportó un caso de HZ recurrente en un niño con VIH positivo25,26,27,28.
El diagnóstico es clínico, pero suele ser difícil en el periodo prodrómico. En pacientes con inmunosupresión puede presentar una distribución y evolución atípica requiriendo en ocasiones confirmar el diagnóstico por estudios de laboratorio, entre éstos el Test de Tzank, detección de antígenos y anticuerpos, inmunofluorescencia, cultivo viral y reacción en cadena de polimerasa6,19.
El tratamiento debe enfocarse al control de los síntomas, impedir una infección secundaria y la administración precoz de antivirales. Éstos últimos deben de iniciarse idealmente dentro de las primeras 72 horas del cuadro agudo; sin embargo, aún después de este lapso de tiempo, si hay evidencia de lesiones nuevas, afección ocular, inmunosupresión o afección del nervio facial deberá administrarse el tratamiento2,6. El aciclovir, famciclovir y valaciclovir han demostrado ser eficientes en reducir la duración del dolor y las lesiones, pero el famciclovir y valaciclovir tienen una mejor biodisponibilidad requiriendo una menor dosis. Pueden utilizarse corticoesteroides como prednisona, cuando hay daño de las ramas motoras19.
Con el advenimiento de la vacuna para el VVZ se pretendía eliminar la incidencia de HZ en la población pediátrica. Esta vacuna es derivada de virus vivos atenuados, está aprobada desde los 12 meses de vida en personas inmunocompetentes, reportándose una eficacia del 90 al 100% con una dosis vacunal. A pesar de su aplicación, seguimos observando casos de HZ en niños, incluso se han reportado casos provocados por la misma cepa vacunal, no obstante, son anecdóticos, leves y no presentan complicaciones8,29. En Madrid, España se describieron 8 casos de HZ en pacientes pediátricos, previamente sanos, entre 18 meses y 5 años de edad, que habían sido vacunados previamente entre los 15 a 17 meses de vida30.
MATERIAL Y MÉTODOS
Se realizó un estudio transversal, observacional y descriptivo de pacientes con HZ.
La población en estudio comprendió pacientes que se diagnosticaron con HZ en el Departamento de Dermatología y Micología del Centro de Investigación y Docencia en Ciencias de la Salud del Hospital Civil de Culiacán en Culiacán, Sinaloa, México en el periodo del año 2010 a 2020.
Se incluyeron pacientes menores de 16 años que acudieron a consulta de dermatología, en la cual se diagnosticó HZ con base a los aspectos clínicos derivados de anamnesis y exploración física. Se solicitó que tutores legales aceptaran participar en el estudio y proporcionaran de forma directa la información requerida para descripción de variables. Se excluyó a pacientes que no acudieron a la cita de control para valorar la duración de las lesiones, se negaran a participar en el estudio y que no contribuyeran con la información necesaria para la descripción de las variables estudiadas.
Las variables demográficas que se incluyeron son edad al momento del diagnóstico de HZ, género, la edad en que presentó varicela, estado inmunitario y presencia de comorbilidades al momento del diagnóstico. La edad al momento del diagnóstico se dividió en grupos de 0 a 4 años, 5 a 9 años y de 10 a 14 años, con fines descriptivos. Basándonos en estudios previos donde se reporta que el riesgo de HZ es mayor en niños que tuvieron una primoinfección de varicela en la edad de 1 a 2 años se dividió esta categoría en grupos de 0 a 1 año, 2 a 3 años y 4 a 6 años. El estado inmunitario y otras comorbilidades de los pacientes se determinaron por interrogatorio y exploración física.
Las variables clínicas que se estudiaron son topografía, morfología, metámera afectada, duración en días de las lesiones cutáneas, presencia de fiebre y sintomatología. La topografía se denominó según el área anatómica afectada. La morfología se agrupó según las lesiones elementales observadas al momento de la exploración física en: 1) eritema y pápulas, 2) eritema y vesículas, 3) eritema, vesículas y presencia de necrosis cutánea. Las metámeras se agruparon acorde al trayecto nervioso involucrado en craneal, cervical, torácica, lumbar y sacra. La sintomatología se describió acorde a lo referido por el paciente en las siguientes categorías: 1) asintomático, 2) prurito, 3) dolor leve, 4) dolor moderado, 5) dolor intenso. La presencia de fiebre se definió como temperatura mayor 38°C cuantificada por el tutor en cualquier momento del curso de la enfermedad o personal de enfermería de la consulta; se clasificó en: 1) Ausencia de fiebre, 2) aparición de fiebre previa a las lesiones cutáneas, 3) fiebre que se presentó después de la aparición de las lesiones cutáneas, 4) fiebre que se presentó previamente y durante la aparición de las lesiones cutáneas. La duración de las lesiones fue cuantificada como número de días desde que se presentó la primera lesión hasta que solo se presentaron costras. Se utilizó estadística descriptiva, calculándose porcentajes y medidas de tendencia central para la presentación de resultados.
RESULTADOS
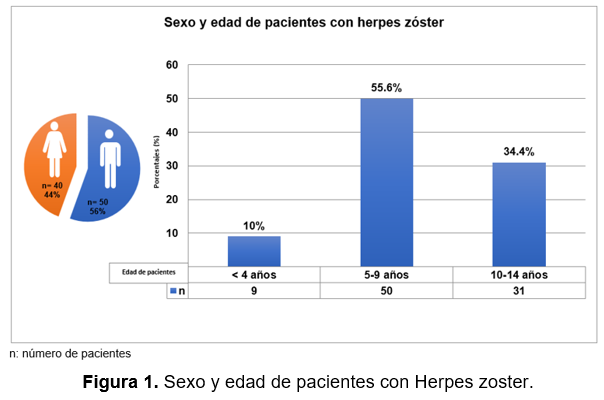
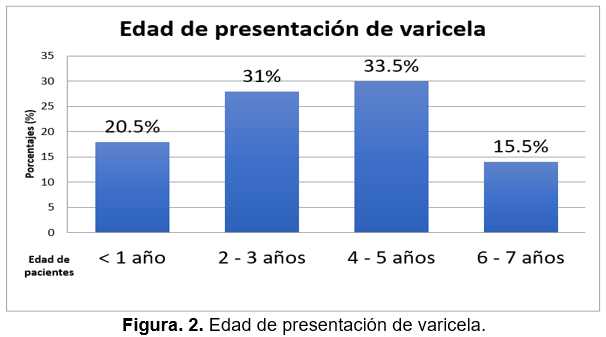
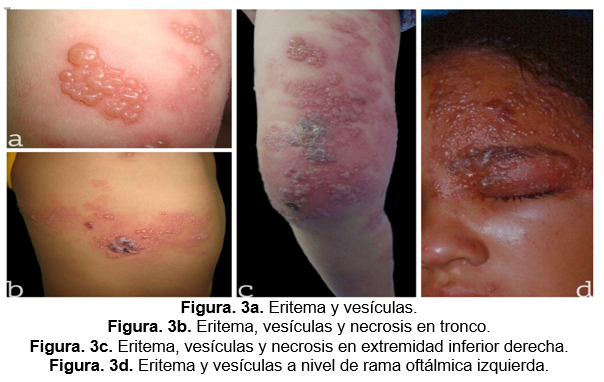
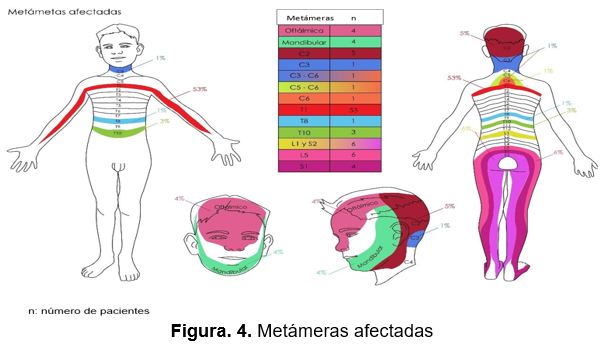
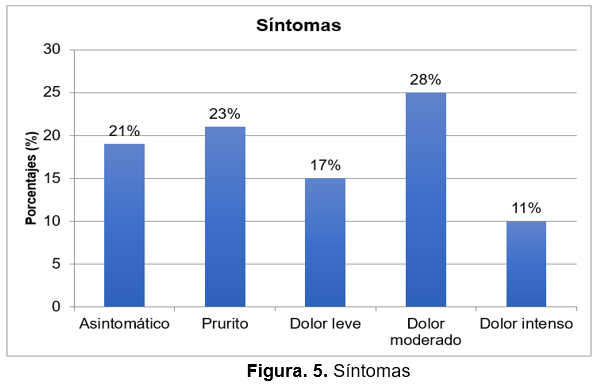
En el periodo de 2010 a 2020 se identificaron 90 pacientes con diagnóstico clínico de HZ, de los cuales 55.5% (n=50) correspondió al sexo masculino y 44.4% (n=40) al sexo femenino (fig. 1). La edad de presentación de los pacientes con HZ mínima fue de 3 años y la máxima de 14 años, 55.6% (n=50) con edad de 4 a 9 años, 34.4% (n=31) con 10 a 14 años y 10% (n=9) de 0 a 4 años (fig. 1). La edad media de la primoinfección por varicela fue 3.55 ± 1.06 años; el 33.5% (n=30) de los pacientes padeció varicela entre los 4 a 5 años, el 31% (n=28) entre los 2 a 3 años, 20.5% (n=18) entre los 0 a 1 años, y el 15.5% (n=14) entre los 6 a 7 años (fig. 2). El 100% de los pacientes se determinó inmunocompetente. El 62.2% (n=56) de los pacientes no presentó ninguna otra enfermedad al momento del diagnóstico de HZ, el 16.6% (n=15) presentó infección de vías respiratorias aguda, el 3.3% (n=3) otitis, 3.3% impétigo, 3.3% dermatitis atópica y 11.1% (n=10) otras enfermedades: vitíligo, fractura de clavícula, fractura de radio-cúbito, fractura de fémur, luxación de cintura escapular, infección del tracto gastrointestinal y postoperatorio de apendicectomía. La topografía de las lesiones que se presentaron fue 60% (n=54) en tronco, en cabeza y cara en 14.4% (n=13), y 4.4% (n=3) en otras áreas hombro, abdomen y región genital, glúteo y muslo y glúteo. La morfología que se observó corresponde en un 77.7% (n=70) a eritema y vesículas (Fig. 3a), en 13.3% (n=12) eritema y pápulas, y en 9% (n=8) a eritema, vesículas y necrosis cutánea (Fig. 3 b y c). La metámera torácica T1 se afectó en el 58% (n=53), L1 y L5 en 6.6% (n=6) cada una, seguido de C2 con un 5.5% (n=5) y 4.4% (n=4) en otras metámeras: oftálmica (fig. 3d), mandibular, y S1 (fig. 4). El síntoma predominante fue el dolor moderado en 28% (n=25) de los pacientes, seguido de prurito en 23% (n=21), 21% (n=19) se reportó asintomático, 17% (n=15) reportó dolor leve y solo 11% (n=10) refirió dolor intenso (fig.5). La fiebre estuvo ausente en el 50% (n=45) de los pacientes, 22.2% (n=20) presentó fiebre previa y durante las lesiones cutáneas, 18.8% (n=17) presentó fiebre durante las lesiones cutáneas y 8.8% (n=8) presentó fiebre previa a las lesiones cutáneas. La evolución en días fue de 4.1 en promedio, con un mínimo de un día y máximo de 7 días, el 28.8% de los pacientes presentó una duración de 3 días.

DISCUSIÓN
El Herpes Zóster se ha considerado un padecimiento raro en la edad pediátrica y ha sido asociado con frecuencia a la inmunosupresión22. En la revisión bibliográfica solo encontramos reportes de casos sobre HZ en niños sanos en nuestro país19,31.
Una serie de casos en Japón reportó que solo 34 de 92 niños con HZ (36.95%) eran niños sin inmunosupresión o enfermedad crónica25. En Alemania una serie de casos de 244 niños hospitalizados por HZ encontró que 78 niños se encontraban inmunosuprimidos27. En contraste, nuestro estudio encontramos que el 100% de los niños se consideró inmunocompetente; además el 62.2% no presentó ninguna comorbilidad al momento del diagnóstico. Otro dato significativo es que las comorbilidades encontradas fueron padecimientos no crónicos. Se ha reconocido que presentar varicela en el primer año de vida es uno de los principales factores de riesgo para desarrollar HZ en la población pediátrica. Takayama y colaboradores reportan en una serie de casos, donde se observó en el grupo de niños inmunocompetentes que la edad media de presentación de varicela fue de 1.6 ± 1.8 años, mientras que nosotros encontramos una edad media de varicela de 3.55 ± 1.06 años, el 80% de los pacientes presentó varicela después de los 2 años de edad. El tórax fue el segmento corporal afectado con mayor frecuencia, concordado con los hallazgos en otras series de casos14,15,25,27. En nuestro estudio solo el 21% de los pacientes se reportó asintomático, enfatizando que el curso asintomático de la enfermedad es infrecuente en nuestro medio, teniendo una evolución clínica similar a la presentación en adultos. Papadopoulus y colaboradores afirman que el dolor rara vez se presenta en niños, la frecuencia en la cual se presentó dolor en nuestros pacientes fue alta, reportando que 50 (55.5%) de 90 pacientes presentó dolor. Además, es importante señalar que la mitad de los pacientes presentó fiebre.
CONCLUSIONES
En este estudio encontramos que el herpes zoster tiene una predominancia de los casos en el sexo masculino, con una edad de presentación media de 4 a 9 años y edad de primoinfección por varicela a los 3 años. Todos los pacientes se determinaron inmunocompententes. La enfermedad se manifestó morfológicamente en su mayoría como eritema y vesículas en el tronco, involucrando el territorio de la metámera T1, con un promedio de 4 días de evolución. La mayoría de los pacientes presentaron síntomas, siendo el dolor el síntoma predominante. Además, la mitad de ellos presentaron fiebre.
REFERENCIAS