Rev Med UAS
Vol. 12: No. 4. Octubre-Diciembre 2022
ISSN 2007-8013
Alba Esthela López-Quintero1, Itzel Irazú Cotero-de la Torre5, Karla Mayela Bravo-Villagra5, Adrián Herrera-Salazar2, Verónica Judith Picos-Cárdenas3, Fred Morgan-Ortíz2, Irak Mijail Trapero-Corona2, José Francisco Muñoz-Valle4*, Andres López-Quintero5
* Correspondencia: (Autoría compartida)
José Francisco Muñoz Valle. Instituto de Investigación en Ciencias Biomédicas, Universidad de Guadalajara. Correo electrónico: biologiamolecular@hotmail.com
Andrés López Quintero. Instituto de Nutrigenética y Nutrigenómica Traslacional, Universidad de Guadalajara. Sierra Mojada 950, Puerta 7, Edificio Q, Primer Piso. Colonia Independencia, C.P. 44340. Guadalajara, Jalisco, México. Correo electrónico: andres.lopezq@academicos.udg.mx +52(33)1058 5200 (ext. 33644)
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v12.n4.010
Texto Completo PDFRecibido 30 de abril de 2022, aceptado 21 de octubre de 2022
RESUMEN
El tejido adiposo sintetiza y secreta una serie de moléculas que intervienen en diversos procesos como la homeostasis energética, inmunidad e inflamación. La adiponectina está involucrada en el control de la homeostasis en tejidos sensibles a la insulina; se encuentra principalmente en circulación cómo oligómeros de distintos pesos moleculares que activan diversas vías de señalización. La implicación de adiponectina y sus isoformas en la regulación de la homeostasis energética y su posible uso como biomarcador pronóstico en la sensibilidad a la insulina generan la necesidad de conocer el impacto de intervenciones que modifiquen sus niveles circulantes o de expresión. Este conocimiento es particularmente importante en la búsqueda de estrategias para mejorar el estado metabólico de sujetos en condiciones metabólicas alteradas como la diabetes gestacional. Por lo que el objetivo de esta revisión fue integrar el conocimiento para mejorar la comprensión sobre la regulación de adiponectina y su aplicación clínica.
Palabras clave: Adiponectina, ADIPOQ, resistencia a la insulina, diabetes gestacional.
ABSTRACT
Adipose tissue synthesizes and secretes a series of molecules implicated in various processes such as energy homeostasis, immunity, and inflammation. Adiponectin is involved in the control of homeostasis in insulin-sensitive tissues; it is mainly found in circulation as oligomers of different molecular weights that activate diverse signaling pathways. The role of adiponectin and its isoforms in the regulation of energy homeostasis and its possible use as a prognostic biomarker in insulin sensitivity, generate the need to know the impact of interventions that modify its circulating or expression levels. This knowledge is particularly important in the search for strategies to improve the metabolic status of subjects with altered metabolic conditions such as gestational diabetes. Therefore, the objective of this review was to integrate knowledge to improve understanding of adiponectin regulation and its clinical application.
Keywords: Adiponectin, ADIPOQ, insulin resistance, gestational diabetes mellitus.
Introducción
El tejido adiposo se considera actualmente como un órgano endocrino que regula la homeostasis de nutrientes y la masa grasa por medio de la liberación de mediadores como son las adipocinas, TNF-α, IL-6, inhibidor del factor activador del plasminógeno, angiotensinógeno y otros,1 que además regulan la inflamación, la aterosclerosis y la sensibilidad a la insulina.2 La adiponectina se ha reconocido como una de las adipocinas más importantes a nivel metabólico por el rol que juega en la homeostasis de glucosa y en la resistencia a la insulina; su estudio es relevante al relacionarse con diversas patologías como lo es el Síndrome Metabólico, Diabetes Mellitus tipo 2, Diabetes Gestacional y algunas enfermedades cardiovasculares.3 Para ejercer sus funciones existen diversos mecanismos y vías de señalización a nivel molecular que se encargan de modular la expresión de esta adipocina. De aquí la importancia de investigar más a fondo sobre estas vías que pudieran dar la pauta para implementar tratamientos dirigidos a la regulación de adiponectina. La relación de esta adipocina con la resistencia a la insulina la han convertido en un posible biomarcador pronóstico y tratamiento diana de patologías relacionadas al aumento de riesgo cardiovascular y disfunción metabólica.4 Por tanto, el objetivo de la presente revisión fue integrar y actualizar el conocimiento de la última década sobre adiponectina en relación a su regulación genética, transcripcional y mediante factores ambientales; con énfasis en ensayos clínicos con modificaciones en el estilo de vida como intervenciones dietéticas y ejercicio en mujeres embarazadas o en sujetos con alguna alteración metabólica relacionada con la sensibilidad a la insulina y riesgo cardiovascular.
METODOLOGÍA
Se realizó una revisión narrativa no sistemática mediante una búsqueda avanzada en la base de datos Pubmed; se introdujeron los términos (ADIPOQ) AND (gene expression), (ADIPOQ) AND (gestational diabetes), (ADIPOQ) AND (Polymorphism), (Adiponectin) AND (exosomes), (adiponectin) AND (isoforms), (adiponectin) AND (gestational diabetes), (gestational diabetes) AND (diagnosis) AND (adiponectin), (adiponectin pathway) y (insulin sensitivity) AND (adiponectin); dentro de un período de 10 años, comprendido entre 2011 y 2021, en los idiomas inglés y español, con los filtros "Clinical Study" "Clinical Trial" "Randomized Controlled Trial" "Observational study" "Multicenter study" "Review" "Books and Documents" "Humans". El método de selección de artículos se basó en una lectura detallada de los títulos, resúmenes y textos completos de los documentos que tuvieran entre sus objetivos describir el gen ADIPOQ, su expresión, variantes genéticas, detallar la estructura proteica, funciones y vías de señalización de la adiponectina, definir la sensibilidad y la resistencia a la insulina, describir la patología de la diabetes gestacional y su relación con la expresión y/o niveles circulantes de adiponectina, como método diagnóstico o pronóstico.
1. Vías de señalización activadas por adiponectina
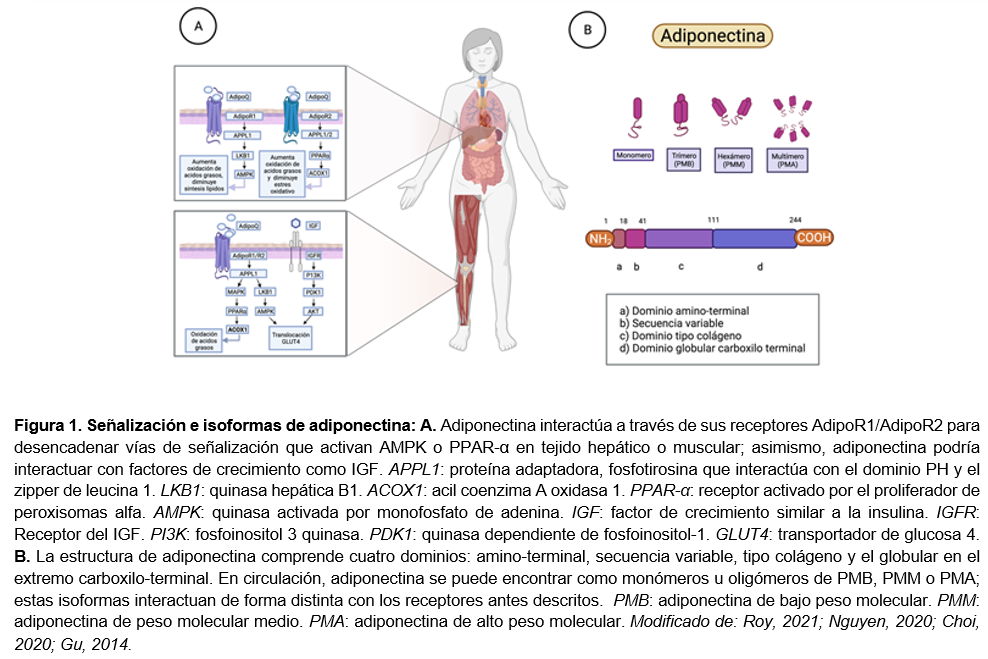
La adiponectina es una adipocina secretada por los adipocitos y se encuentra presente en el plasma y en algunos tejidos como hígado, músculo, tejido esquelético, osteoblastos, cardiomiocitos, linfocitos, glándulas adrenales, ovarios, placenta, testículos e hipófisis, es codificada por el gen ADIPOQ en humanos que se localiza en 3q27. En niveles altos se le atribuyen efectos positivos a nivel cardiovascular, además de estar relacionada directamente con la homeostasis de glucosa.5 Se le conoce con diversas nomenclaturas como ACRP30, AdipoQ, apM1, GBP28, ApN.1,6 Está formada por 244 aminoácidos y cuenta con un peso molecular de 28 kDa en humanos. Su estructura molecular se compone de una región de señalización en su grupo NH2 terminal, una región variable, un dominio colágeno y un dominio globular en su grupo COOH terminal.5,6 A nivel plasmático podemos encontrar oligómeros de adiponectina circulando en distintas formas multiméricas. Cerca del 90% de adiponectina circulante se encuentra unida a una estructura de alto peso molecular (PMA) o de bajo peso molecular (PMB), el 10% restante circula en forma de trímeros compuesto por 3 moléculas de adiponectina.7 La hidroxilación y glicosilación de las 4 lisinas del dominio colágeno juegan un papel importante en mejorar las concentraciones de insulina para inhibir la gluconeogénesis en los hepatocitos.1 Se ha descrito que la adiponectina inhibe la expresión de fosfoenol piruvato carboxiquinasa y glucosa-6-fosfatasa suprimiendo en consecuencia la gluconeogénesis.8
La adiponectina se encuentra presente en el plasma en su forma globular, como resultado de la proteólisis, pero en cantidades muy pequeñas. La forma globular de adiponectina puede activar la vía cinasa activada por monofosfato de adenina (AMPK) en músculo esquelético e incrementar la fosforilación de coenzima A carboxilasa (CoAC), oxidación de ácidos grasos, producción de lactato en miocitos y captación de glucosa, reduciendo la gluconeogénesis en hígado.9,10,11 Las isoformas de adiponectina tienen diferentes propiedades biológicas y por lo tanto, diferentes objetivos tisulares. Para poder ejercer sus propiedades biológicas la adiponectina debe unirse a ciertos receptores específicos como lo son AdipoR1, AdipoR2 y cadherina-T. La expresión y afinidad de estos receptores por adiponectina es distinta. Particularmente, cadherina-T presenta mayor afinidad por la isoforma PMA y posee la capacidad de iniciar una vía de transducción de señal por sí misma,5,12 los receptores se expresan en adipocitos principalmente, pero cada uno tiene una expresión distinta en diferentes tejidos, mientras que AdipoR1 se expresa en músculo esquelético principalmente, AdipoR2 se expresa en hígado.1 Estos receptores son los responsables de los efectos biológicos de la adiponectina, como lo es el aumento en la sensibilidad a la insulina y el aumento en la captación de glucosa en músculo esquelético. Los genes de estos receptores se encuentran localizados en el cromosoma 1, locus 1p36.13-q41 y en el cromosoma 12, locus 12p13.31, respectivamente.5 El bloqueo genético de AdipoR1 provoca aumento en la gluconeogénesis y disminución en la activación de AMPK, mientras que la eliminación de AdipoR2 provoca un deterioro de la captación de la glucosa acompañado de una disminución en la actividad del receptor alfa activado por peroxisomas (PPAR-α) en el hígado. Por otro lado, la sobreexpresión hepática de AdipoR1 y AdipoR2 mejora la sensibilidad a la insulina y la sobreexpresión de AdipoR1 en el músculo esquelético aumenta la captación de glucosa y la síntesis de glucógeno.13 Existen diferentes reguladores a nivel transcripcional y postraduccional, tal como, PPAR-γ considerado como un indicador positivo para la expresión de adiponectina. C/EBPα se considera un factor transcripcional clave para la síntesis de adiponectina y por último SREBP otro factor transcripcional asociado a la síntesis en el adipocito.12 Se ha encontrado que existe una proteína de unión intracelular que actúa junto a los receptores AdipoR1 y AdipoR2 llamada APPL1, las variantes genéticas en el gen de esta proteína se correlacionan con la distribución de la grasa corporal y una alta prevalencia de diabetes. Esta proteína se une directamente a los dominios intracelulares de los receptores AdipoR1 y AdipoR2 mediando así las acciones de la adiponectina en la regulación del metabolismo energético y la sensibilidad a la insulina. Otra de las vìas por la cual se ha descrito el incremento de la sensibilidad a la insulina es por medio del aumento en la expresión del sustrato del receptor de insulina tipo 2 (IRS2) hepático, por medio de una vìa dependiente de IL-6 y posterior inducción de STAT3.6 La señalización a través de los receptores antes descritos conduce a la activación de vías como AMPK y PPAR-α.9,14
La adiponectina activa vías de señalización para ejercer sus funciones a nivel metabólico y dependiendo del tejido donde se exprese, algunas de estas vías ya conocidas son AdipoR1, AdipoR2, AMPK, Ca2+, PPAR-α y ceramidas, por medio de estas es que se pueden llevar a cabo ciertos procesos, por ejemplo la disminución del estrés oxidativo a nivel de tejido músculo esquelético, aumento de la sensibilidad a la insulina, reducción de la síntesis de lípidos con una mejora en la homeostasis de los mismos, aumento de la biogénesis mitocondrial, prevención de la apoptosis endotelial con la consiguiente producción de sustancias antiinflamatorias como la IL-10.6,15,16
Algunos estudios han aclarado cómo APPL1 modula la activación de AMPK mediada por adiponectina a través de la quinasa B1 (LKB1). APPL1 se activa con adiponectina e interactúa con la proteína fosfatasa 2A (PP2A) y con la proteína quinasa C (PKC-zeta), su unión activa a PP2A y desfosforila a PKC-zeta, generando, una reducción en la fosforilación de LKB1 lo que provoca la translocación del núcleo al citosol de LKB1 para interactuar con APPL1 y activar AMPK. Algunos hallazgos demuestran que la expresión de APPL1 se encuentra asociada con la obesidad y la sensibilidad a la insulina; el aumento en la expresión de APPL1 podría contribuir al desarrollo de DM2 en humanos.13
La activación de AMPK inducida por adiponectina previene la inflamación del miocardio y la miocardiopatía diabética a través de un aumento en la oxidación de ácidos grasos; en hígado conduce a una disminución de la gluconeogénesis y disminuye la biosíntesis de lípidos mediante la inhibición de esteroles (ver figura 1A); en páncreas aumenta la oxidación de ácidos grasos a través de la inhibición de CoAC. La activación de ceramidasas inducida por adiponectina previene la apoptosis de los cardiomiocitos. Los AdipoRs al elevar la captación de glucosa mediada por APPL1-Rho-ROCK previene la cardiopatía diabética. La activación de la cascada Sphk-1-COX-2 inducida por adiponectina previene el infarto al miocardio. Mientras que en médula ósea, la adiponectina aumenta la diferenciación de osteoblastos a través de la expresión y activación de COX-2.17
La adiponectina ha sido propuesta como un potencial biomarcador pronóstico y tratamiento diana para la aterosclerosis, la inflamación, la resistencia a la insulina en pacientes con enfermedades cardiovasculares, síndrome metabólico (SM), obesidad y DM2, incluso algunos autores han relacionado los niveles altos de adiponectina con una disminución del riesgo de DM2 ya que se conoce que estimula la secreción de insulina y captación de glucosa por parte de los tejidos periféricos suprimiendo la producción de glucosa a nivel hepático.4 Un enfoque distinto, de acuerdo a varios autores, es la búsqueda de nuevos fármacos dirigidos para modular la expresión/activación de la adiponectina en tejidos específicos, inducir la activación de los receptores de adiponectina y la señalización de efectores río abajo, lo cual podría ser beneficioso para aquellos casos de resistencia a la adiponectina y tratar los efectos del SM.10,17
La principal acción sensibilizante a la insulina de la adiponectina resulta de la disminución de la gluconeogénesis hepática y un aumento del transporte muscular de glucosa. En segundo lugar, de la mejora del consumo de energía y oxidación de ácidos grasos en tejidos periféricos con el objetivo de aumentar la producción de ATP. La disminución resultante de los niveles de lípidos a nivel hepático y músculo esquelético aumenta la sensibilidad a la insulina.3
Los niveles circulantes de adiponectina se incrementan posterior a la pérdida de peso, sin embargo, si solo se realiza ejercicio y no existe una pérdida de peso significativa, no aumentarán los niveles de adiponectina, pero si mejorará la resistencia a la insulina, esto sugiere que existen vías de sensibilización a la insulina distintas a la modulación de adipocinas.3 Varios estudios demuestran que la expresión de AdipoR1 y AdipoR2 pueden cambiar si se realiza ejercicio lo que puede contribuir a mejorar la sensibilidad a la adiponectina, sin embargo se requiere mayor investigación a esta posibilidad.18
Los niveles de adiponectina circulante están altamente relacionados con niveles bajos de colesterol HDL y niveles altos de triglicéridos, considerándose como biomarcador importante del síndrome metabólico.3 Por su parte, la obesidad además de disminuir los niveles de adiponectina en plasma, disminuye la expresión de AdipoR1/R2, lo que reduce la sensibilidad a la adiponectina y conduce a la resistencia a la insulina.16,18
Durante el embarazo, las mujeres con obesidad o diabetes gestacional (DG) usualmente presentan niveles bajos de adiponectina circulantes y se encuentra asociado con un incremento en el crecimiento fetal. La señalización de adiponectina en músculo esquelético e hígado en mujeres embarazadas incrementa la sensibilidad a la insulina, mientras que la adiponectina presente en placenta promueve la resistencia a la insulina.19

2. Isoformas de la adiponectina
La adiponectina es una proteína multimérica, estructuralmente similar al complemento C1q, contiene un dominio similar al colágeno nitrógeno terminal y un dominio globular carboxilo terminal. Conforme a esta estructura se conocen tres isoformas: La isoforma PMB está compuesta por trímeros con un peso de 60 kDa; la adiponectina de peso molecular medio (PMM) por hexámeros de 150 kDa; y la de PMA, por multímeros de 12 a 32 monómeros de 420 kDa (ver figura 1B).20
A nivel poblacional, se ha encontrado que las mujeres tienen niveles más altos de adiponectina total y de PMA que los hombres; además se han descrito variaciones entre grupos étnicos, donde los asiáticos y los latinos tienen niveles de adiponectina total y de PMA más bajos que los caucásicos.21
La isoforma de PMA se considera la adiponectina con mayor actividad biológica, ya que participa en la sensibilidad a la insulina, la captación de glucosa y el metabolismo lipídico. Por otra parte, la adiponectina globular se ha visto involucrada en efectos proinflamatorios, aumentando los niveles de IL-8, GM-CSF y de la MCP-1, además de ser un fuerte activador de la vía NF-κB.20
Por otra parte, se ha visto que la tasa de aclaramiento de adiponectina, con una media de 30 a 90 minutos, difiere entre sus distintas isoformas. En la circulación la isoforma de PMA tiene una vida más larga, con una media de 83 minutos, mientras que la isoforma de PMB tiene la vida media más corta con 32 minutos aproximadamente.21
Múltiples estudios han intentado explicar las diferencias entre los fenotipos de los sujetos de estudio basado en las isoformas de adiponectina. Un ejemplo, fue en un estudio multicéntrico donde se estudiaron dos variantes étnicas en el gen ADIPOQ, G45R (hispanoamericanos) y R55C (afroamericanos), donde encontraron niveles medios de adiponectina 20% menores a los no portadores, pero sin diferencias clínicas o bioquímicas; las muestras de suero de los portadores mostraron una ausencia de la isoforma PMA y una marcada reducción en la isoforma PMM, pero un aumento aproximado del doble en la isoforma de PMB, argumentando un efecto compensatorio en la pérdida o reducción de otras isoformas.22
3. Sensibilidad a la insulina y su relación con la adiponectina
La sensibilidad a la insulina se da mediante la sinergia de factores metabólicos, donde interviene la genética, la epigenética, la activación o inhibición de diversas vías metabólicas, el estilo de vida, patologías y estadios fisiológicos como lo es el embarazo. En contraparte, la resistencia a la insulina es la alteración de la respuesta celular a la insulina, con alteraciones metabólicas en el hígado, músculo esquelético y tejido adiposo blanco, que se caracteriza clínicamente por hiperinsulinemia y dislipidemia.23
Se ha encontrado que la adiponectina es responsable de hasta un 73% en la variación de la sensibilidad a la insulina.24 Uno de los múltiples mecanismos que emplea para mejorar los efectos de la insulina, es por medio de la estimulación de la (AMPK), lo que da como resultado una mayor fosforilación de la CoAC, y con ello, la disminución de la expresión hepática de enzimas gluconeogénicas, como fosfoenolpiruvato carboxiquinasa y glucosa-6-fosfatasa; que en consecuencia disminuye la producción endógena de glucosa hepática (gluconeogénesis). Asimismo, aumenta la oxidación de ácidos grasos y la captación de glucosa en el músculo esquelético a través de la activación de PPAR-α.23
A su vez, la adiponectina promueve la secreción de insulina estimulada por glucosa mediante la fosforilación de la proteína adaptadora APPL1, con la posterior señalización de PPAR-γ y la vía fosfatidilinositol 3 cinasa (PI3K/Akt), que desencadena mecanismos antiapoptóticos en las células beta pancreáticas.25
Los adipocitos hipertróficos causan resistencia a la insulina y SM relacionado con la obesidad. La adiponectina, por su parte, promueve el almacenamiento lipídico en los depósitos de grasa subcutánea, ya que el depósito de lípidos en el tejido visceral conduce a una inflamación sistémica. De hecho, esta adipocina se conoce por sus efectos antiinflamatorios que mejoran la sensibilidad a la insulina; promueve la polarización de los macrófagos hacia el fenotipo M2 (antiinflamatorio) y atenúa la expresión del fenotipo M1 (proinflamatorio).26
De igual forma, la sobrealimentación crónica rica en ácidos grasos saturados y la elevación concomitante de los niveles de insulina dan como resultado una disminución de la expresión de los receptores de adiponectina (AdipoR1/R2), con lo cual no existe la unión receptor-proteína y conlleva a un descenso en los efectos de la adiponectina, definiendo este efecto como resistencia a la adiponectina. En consecuencia, la resistencia a la insulina junto con la resistencia a la adiponectina forman un círculo vicioso.27
Otro factor fundamental en la regulación de la acción de la insulina es la microvasculatura. Para que la insulina actúe sobre las células musculares, primero debe transportarse a través del endotelio capilar para ingresar al espacio intersticial antes de que pueda unirse a su receptor en el miocito, y una expansión del área de superficie de intercambio endotelial aumentará notablemente los niveles de insulina. Por eso, se ha demostrado que el ejercicio, la angiotensina 1–7, los bloqueadores del receptor tipo 1 de la angiotensina II, el resveratrol, el péptido 1 similar al glucagón, la ranolazina y la adiponectina, mediante su efecto vasodilatador poseen propiedades sensibilizantes a la insulina.28
Clínicamente es posible la evaluación precisa de la resistencia a la insulina mediante el método de la pinza euglucémica hiperinsulinémica ("estándar de oro" para determinar esta condición metabólica); sin embargo, la complicidad de esta técnica, por el potencial peligro inherente de hipoglucemia, limita su uso rutinario.29 De ahí, la necesidad de crear otros instrumentos de medición como la evaluación del modelo homeostático (HOMA-IR) o la proporción leptina/adiponectina.30 Algunas hepatocinas y adipocinas han sido propuestas para la evaluación de la sensibilización de la insulina. Dentro de las hepatocinas sensibilizadoras se encuentran el factor de crecimiento de fibroblastos humanos 21, el cual mejora la captación de glucosa del músculo esquelético y tiene efectos antiapoptóticos; la vaspina, con efectos antiinflamatorios; la grelina que modula la señalización del receptor de insulina y la secreción de insulina; y la omentina que se correlaciona positivamente con la adiponectina. En contraparte, están las adipocinas que favorecen la resistencia a la insulina como la leptina, reguladora del apetito, cuyos niveles séricos son directamente proporcionales a la masa grasa y se contraponen a los niveles de adiponectina; la proteína de unión a ácidos grasos de adipocitos, que media el transporte de ácidos grasos y cuyos niveles fueron predictivos en el desarrollo de DM2; la resistina, que tiene un papel inflamatorio en la función de las células B del páncreas; la apelina, asociada a la obesidad; la quemerina, correlacionada con el IMC, el perfil lipídico, la presión arterial y el desarrollo de DM2; la fetuína B, la cual reduce la supresión de la gluconeogénesis mediada por insulina; TNF-α, citocina proinflamatoria que induce la resistencia a la insulina mediante la inhibición de la expresión del transportador GLUT4; y la IL-6, que reduce la fosforilación del sustrato del receptor de insulina (IRS) y Akt.29,31
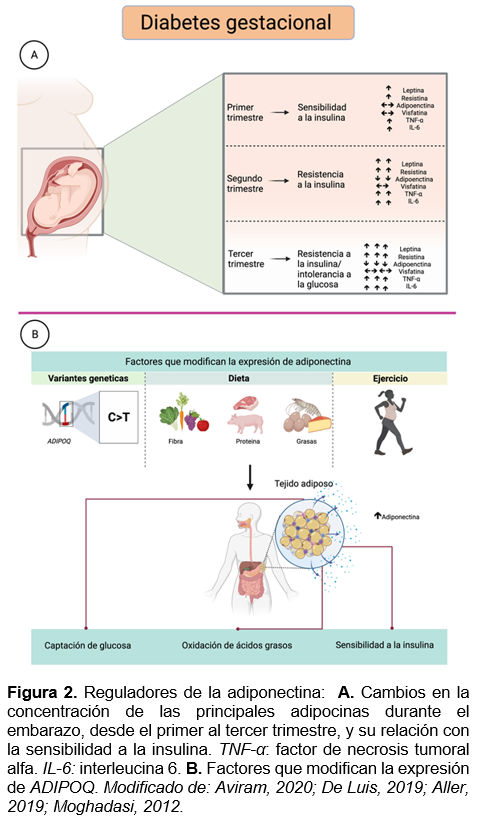
Por otro lado, el embarazo es un estado que implica varios cambios anatómicos y fisiológicos, siendo uno de los más importantes la alteración de la sensibilidad a la glucosa. En la segunda mitad del embarazo, la sensibilidad a la insulina disminuye tanto que la secreción de insulina debe aumentar de 2 a 2.5 veces en comparación con los valores de pregravidez, los niveles de ácidos grasos libres posprandiales aumentan y el metabolismo de la glucosa mediado por la insulina se reduce a aproximadamente un 50%. La diabetes gestacional (DG), por su parte, se desarrolla cuando la secreción de insulina no es suficiente para compensar el aumento de la resistencia a la insulina durante el embarazo. Los mecanismos responsables del desarrollo de la DG no se conocen por completo, no obstante se han visto involucradas adipocinas como la adiponectina, la leptina, la resistina, la omentina, la apelina, la quemerina, la IL-6, el TNF- α, entre otras.32 (Ver figura 2A)
4. Variantes genéticas en el gen ADIPOQ
La síntesis de adiponectina tiene un fuerte componente genético, con un factor hereditario estimado de aproximadamente 70%; en consecuencia, las variantes genéticas de un solo nucleótido (SNV) se han visto relacionadas con los niveles séricos de adiponectina. De Luis (2019) demostró, mediante un ensayo clínico aleatorizado, la influencia de una dieta hipocalórica rica en ácidos grasos insaturados (poliinsaturados y monoinsaturados) sobre los valores circulantes de adiponectina, ya que funcionan como ligandos para el factor de transcripción PPAR-γ, el cual regula a la alza la expresión del gen ADIPOQ y por ende aumenta los niveles de adiponectina. En ese estudio se encontró que el genotipo GG de la variante ADIPOQ rs1501299 se asoció a una mejora significativa en los niveles de adiponectina, insulina y una disminución de la resistencia a la insulina (valorado por HOMA-IR) después de dos dietas hipocalóricas con diferente perfil de grasas insaturadas.33 Por otro lado, una intervención en sujetos con SM sometidos a una dieta rica en ácidos grasos saturados (AGS) durante 4 semanas, posteriormente cambiada a una dieta rica en ácidos grasos monoinsaturados (AGMI) por 24 semanas más; demostró que la dieta rica en AGS con el alelo de riesgo T (rs1501299) en la posición +276 se encuentra asociado a una concentración mayor de adiponectina sérica; mientras que los sujetos con el alelo A (rs17300539) en la posición -11391 con una dieta rica en AGMI tenían menor índice de masa corporal (IMC) y menor riesgo de obesidad en comparación con el alelo G.34 De forma análoga, se probaron otras dietas con resultados similares, como una dieta hipocalórica con alto porcentaje en proteínas y baja en carbohidratos, en donde se encontró que el genotipo GG del polimorfismo rs1501299 de ADIPOQ se relaciona con una aumento en los niveles séricos de adiponectina, una mejoría tanto en la resistencia a la insulina como en el perfil lipídico, comparado con los portadores del alelo T;35 mientras que, en una dieta Mediterránea hipocalórica se descubrió que el alelo T de ADIPOQ (rs1501299) podría ser un predictor de falta de respuesta al HOMA-IR, a la insulina, glucosa en ayunas y colesterol LDL, en sujetos obesos.36,37 Por otro lado, los sujetos con genotipo CC del SNV rs266729, ubicado en la región promotora proximal del gen ADIPOQ, mostraron una mejor respuesta de los niveles de colesterol LDL, HOMA-IR, insulina y adiponectina que los portadores del alelo G antes de la pérdida de peso provocada por la misma dieta.38 Siitonen y colaboradores, basándose en la premisa de un plan personalizado de dieta intensiva y ejercicio encontraron que en individuos con el alelo G de la variante rs266729 presentaron mayor peso corporal y menor riesgo de DM2 que los individuos con el genotipo CC. Por último, se encontró que el alelo G de la variante rs6773957 estaba asociada a bajas concentraciones de adiponectina y a mayor peso corporal.39,40 En pacientes chinos con SM se encontró que los niveles de triglicéridos (TG) eran menores en individuos con genotipo CG para la variante rs266729 y los niveles de colesterol HDL fueron mayores en comparación con el genotipo CC. Mientras que para la variante rs16861205 los individuos con el genotipo AA presentaron menores niveles de glucosa con respecto a aquellos individuos con genotipo GG. Por otro lado los individuos con genotipo CC para la variante rs1063539 mostraron mayores cifras de presión arterial sistólica y diastólica comparada con individuos con genotipo GG.41 Otro estudio realizado en población china demostró que para el genotipo AT de la variante rs7649121 y AG de la variante rs2241767 presentan mayor riesgo de padecer DM2.42
Asimismo, se ha informado acerca de la relación entre la adiponectina y la grasa visceral, donde el aumento de la segunda ocasiona la disminución de la primera, desencadenando una probable resistencia a la insulina y enfermedades como la DM2. Existen variantes relacionadas a estos trastornos metabólicos; los SNV rs10937273 y rs1648707, en la región reguladora de ADIPOQ, se asociaron con niveles reducidos en adiponectina y una resistencia a la insulina independiente de la acumulación de grasa visceral, en mujeres japonesas; estas SNV afectan la sensibilidad a la insulina mediante la regulación de la producción de adiponectina del tejido adiposo.43 El alelo G del gen de la adiponectina en la posición -11377 (C/G) aumentó el riesgo 2.64 veces a desarrollar diabetes mellitus tipo 1 (DM1), ya que se correlaciona con un nivel bajo de adiponectina, por lo que se le considera un buen predictor de la enfermedad.44
En cuanto a los estudios con los genotipos SNV276, SNV45 y la variante rs222857, se encontró que están relacionados con niveles bajos de adiponectina; y que la actividad física en los portadores influye de la misma manera que en en los no portadores sobre los valores circulantes de adiponectina, cuando se interviene a sujetos obesos con ejercicio aeróbico o de resistencia; esto debido a que influyen otros factores como el mejoramiento de la aptitud cardiorrespiratoria y la sensibilidad a la insulina.45,46
Mediante un análisis basado en microsatélites, Hollewege y colaboradores consideraron dos puntos importantes para realizar el estudio; el primero, los niveles proteicos de adiponectina en plasma y el segundo, el análisis del gen ADIPOQ. El estudio se realizó en 88 familias hispánicas con aterosclerosis por resistencia a la insulina. Los datos fueron recopilados de diversas fuentes considerando variantes de alto impacto y baja frecuencia, encontraron asociación de la variante rs200573126 presente en 7 de 88 familias estudiadas con una frecuencia presente del 1.1%.47
5. Expresión génica del gen ADIPOQ
La regulación de la expresión de adiponectina se da a través de modificaciones en el estilo de vida como dieta y ejercicio (ver figura 2B); lo cual se ve reflejado en ensayos de intervención dónde se analizaron los efectos del aceite de canola enriquecido con ácido docosa-hexanoico,48 los AGS y los ácidos grasos poliinsaturados (AGPI).49 Así como, la evaluación del ejercicio y antecedentes de historia familiar de DM50 o el entrenamiento de alta intensidad.51
En un estudio de intervención nutricional controlado aleatorizado y cruzado se investigó el efecto de 5 aceites con diversas concentraciones de ácido alfa-linolénico (ALA), ácido linoleico (AL), ácido oleico (AO) y ácido decosahexanoico (ADH) sobre biomarcadores plasmáticos de inflamación y expresión de ciertos genes relacionados. Las intervenciones se realizaron por cuatro semanas con periodos de lavado de 2-4 semanas en sujetos con obesidad abdominal y por lo menos otro criterio para la definición de SM. El aceite de canola enriquecido con ADH incrementó las concentraciones plasmáticas de adiponectina comparado con el tratamiento control a base de aceite de maíz (+4.5% µg/L vs +0.37%, p=0.04) así como con el aceite de linaza (+6.9%, p=0.0008). Aunque no existe una evaluación de la expresión génica de ADIPOQ, se encontró que el aceite de canola enriquecido con ADH redujo la expresión relativa de IL1B comparado con aceite de maíz y canola (-11% y -13%, respectivamente). En consecuencia, se propone que los efectos anti-inflamatorios del ADH podrían ocurrir a través de la regulación a la baja de IL1B.48
La composición dietética de grasa podría modificar el epigenoma en tejido adiposo, por lo que en un ensayo clínico doble ciego aleatorizado se evaluó el impacto de 7 semanas con una ingesta excesiva en AGS o AGPI sobre la metilación en tejido subcutáneo de seres humanos. Se observó que la sobrealimentación con AGS o AGPI confieren cambios en los patrones de metilación. La sobrealimentación incrementó significativamente la metilación promedio de las islas CpG en tejido adiposo. Particularmente, se observó que la metilación de 4875 sitios CpG fue diferente entre las intervenciones. Los AGPI condujeron a una modificación en la metilación promedio de 1797 genes, de los que destacan FTO, IL6, INSR y POMC, aunque no hubo modificación a nivel transcripcional; por otro lado, los AGS modificaron la metilación en 125 genes, tal como ADIPOQ y la expresión de 28 transcritos. Aunado a lo anterior, la metilación de 12 sitios CpG se asoció con el incremento de peso en respuesta al exceso de energía.49
Se ha descrito que la hijas de pacientes con diabetes tienen menor sensibilidad a la insulina que mujeres sin historia familiar positiva de diabetes, no obstante, su sensibilidad a la insulina mejora en mayor medida con el ejercicio. En un estudio de intervención con ejercicio durante 7 semanas en mujeres con al menos un padre con DM2 y aquellas sin familiares de primer o segundo grado con DM2, se observó una disminución significativa de la masa grasa. En el grupo control se observó una disminución significativa en la masa grasa, adiponectina plasmática y el ARNm de la leptina. Así, mujeres con antecedentes familiares de DM2 mostraron una mayor sensibilidad a la insulina y el ARNm de LEPR (isoforma larga del receptor de leptina) post-intervención. En contraparte, se disminuyó la masa grasa, adiponectina y leptina plasmática. En ambos grupos la expresión de los genes ADIPOQ, ADIPOR1 y ADIPOR2 no mostraron diferencias. Para todas las participantes se mostró una correlación positiva de la sensibilidad a la insulina con los niveles circulantes de adiponectina y de forma negativa con los niveles circulantes de leptina. Se concluye que los cambios en leptina se relacionan más fuertemente con los cambios en la sensibilidad a la insulina por ejercicio en comparación con adiponectina.50
Moghadasi y cols., condujeron un estudio de intervención con ejercicio por 12 semanas en el que se incluyeron 16 hombres con sobrepeso y obesidad (41 años en promedio), en donde se mostró un incremento en la expresión génica de adiponectina en tejido adiposo subcutáneo de abdomen y glúteo en comparación con el grupo control. Además, los niveles plasmáticos de adiponectina se elevaron y la resistencia a la insulina disminuyó posterior al entrenamiento comparado con el grupo control. Cuándo los sujetos se sometieron a una semana sin entrenamiento, no se observaron modificaciones en las variables para el grupo de intervención. Por lo que, un entrenamiento de resistencia de alta intensidad condiciona a un incremento de los niveles de ARNm de adiponectina en sujetos hombres con obesidad. Los autores sugieren que el ejercicio de alta intensidad podría incrementar los niveles de adiponectina cuando se realiza una intervención que se acompaña de reducción de peso, masa grasa y resistencia a la insulina.51
6. Adiponectina y Diabetes Gestacional
La diabetes gestacional (DG) es una patología donde hay una resistencia a la insulina transitoria debido a la incapacidad de las células ß pancreáticas para satisfacer las necesidades de insulina del cuerpo, además hay una desregulación en las adipocinas, donde la adiponectina, con propiedades antiinflamatorias y efectos sensibilizantes a la insulina, disminuye su concentración, mientras que la leptina, involucrada en procesos de inflamación, obesidad y la resistencia a la insulina, eleva sus valores. Los cocientes adiponectina/leptina (A/L) y leptina/adiponectina (L/A), se han convertido en posibles marcadores para detectar resistencia a la insulina y DG, en etapas tempranas del embarazo, siendo significativamente menor en mujeres obesas.2 Por otro lado, se ha visto que el cociente adiponectina/HOMA-IR (A/H) actúa como un importante biomarcador del SM, incluso con más fuerza que el HOMA-IR o la adiponectina por sí solos.52
Se han intentado implementar medidas terapéuticas que aumenten la sensibilidad a la insulina en pacientes con DG, de entre ellas está la administración de inositol fosfoglicano, un mediador intracelular de la señal de insulina que se correlaciona con la sensibilidad a la insulina en la DM2, el cual mostró una disminución del HOMA-IR tanto en mujeres con DG como en mujeres sin DG (50% en el grupo de estudio frente al 29% en el grupo de control), aunque no se informaron diferencias significativas para la adiponectina.53 De igual forma, se han intentado aumentar los niveles de adiponectina en la leche materna mediante dieta y suplementación con probióticos, donde la intervención dietética aumentó la concentración de adiponectina en el calostro, con una diferencia significativa al compararla con el grupo control (12.7 ng/mL [10.6-29.7] frente a 10.2 ng/mL [9.9-13.2]), concluyendo en la importancia del estado nutricional durante el embarazo, y considerando que la adiponectina en calostro tiene efectos potenciales sobre el metabolismo, la nutrición y la función inmunológica en los recién nacidos.54
El índice HOMA-IR así como el índice de comprobación cuantitativa de sensibilidad a la insulina (QUICKI) se han propuesto como predictores prometedores para la necesidad de tratamiento médico en las pacientes con DG. Así lo demuestra el estudio prospectivo observacional realizado por Aviram y colaboradores en el que se encontró que la combinación de HOMA-IR y QUICKI podían predecir la necesidad de medicación en primer trimestre con una especificidad del 90%, pero con una sensibilidad baja. Sin embargo, observaron que el mejor modelo de predicción fue la combinación de HOMA-IR, QUICKI, edad materna, medición de glucosa plasmática en ayuno en primer trimestre y los valores de resistina, el cual presentaba una sensibilidad y especificidad cercana al 90% (87.5%).55 Así mismo, se ha propuesto desarrollar herramientas que permitan evaluar el riesgo que presentan las pacientes obesas con distintos factores de riesgo metabólico para desarrollar DG. White demuestra en un estudio de cohorte prospectivo realizado en 2016, que el uso de modelos predictores que combinan variables clínicas y antropométricas (edad, antecedente de DG, antecedentes familiares de DM2, presión arterial sistólica y la suma del grosor de pliegues cutáneos) presentó un ROC de 0.71 (IC 95%, 0.68+ 0.74) aumentando a 0.77 (IC 95%, 0.74+ 0.81) cuando se añadía la medición de biomarcadores candidatos (glucosa al azar, HbA1c, fructosamina, adiponectina, globulina de unión a hormonas sexuales y TG).56
Se ha propuesto que el IMC elevado en pacientes con SM puede actuar como un predictor de riesgo para presentar DG, utilizando como punto de corte 24.5 kg/m2, además se ha encontrado que a partir de este nivel se incrementa la probabilidad de presentar un feto macrosómico o grande para la edad gestacional.57 Así mismo, se ha descrito que la vitamina D contribuye a disminuir los índices inflamatorios en diversas patologías asociadas a riesgo metabólico como lo es la DG, ya que activa la transcripción del gen receptor de insulina y por lo tanto ayuda a regular la transcripción de genes que se asocian con la invasión placentaria y angiogénesis, por lo que la deficiencia de la misma pudiera favorecer a un perfil cardiometabólico no apto durante la gestación, así como un aumento en la incidencia de resultados adversos durante la misma, con base en esto, sería beneficioso aumentar el consumo de esta vitamina ya que además pudiera incrementar los niveles de adiponectina sérica suprimiendo algunas sustancias pro-inflamatorias como el gen TNF-α y el sistema renina angiotensina en el tejido adiposo.58 En un estudio de cohorte realizado por Li y colaboradores, se encontró que diversos biomarcadores como lo son adiponectina y leptina, pudieran evaluarse en el recién nacido para predecir el riesgo de obesidad y diabetes futura, se ha descrito que niveles bajos de adiponectina se asociaría a una menor adiposidad en la descendencia durante los primeros años de vida.59
El uso clínico de estos modelos predictores nos permitiría la evaluación de las pacientes desde el inicio de la gestación detectando a aquellas pacientes con mayor riesgo de DG para actuar de acuerdo a esto, enfocado en el manejo ya sea farmacológico o con cambios en el estilo de vida (dieta y ejercicio).
La obesidad materna y algunas características presentes en el SM representan factores de riesgo importantes para el desarrollo de DG, así como de resultados adversos durante la gestación. Migda y colaboradores en 2017 realizaron un estudio observacional en el cual encontraron que las mujeres embarazadas que dan a luz a neonatos macrosómicos o grandes para la edad gestacional tienen un nivel de adiponectina sérica durante el primer trimestre que es significativamente menor que la de mujeres embarazadas sin fetos macrosómicos, además observaron el incremento de colesterol total y LDL en embarazos con fetos grandes para la edad gestacional, lo cual sustenta el rol de la dislipidemia como potencial causa del incremento del peso fetal.60 De la misma manera se ha descrito una correlación positiva de HOMA-IR con el peso del recién nacido en gestantes adolescentes.61 Se han reconocido ciertas características clínicas, las cuales, en conjunto con la obesidad materna se consideran los principales factores de riesgo para el desarrollo de DG como lo son: pertenecer a una etnia de alto riesgo, antecedente de hijos macrosómicos, DG en embarazos previos, familiares de primer grado con DM2, entre otros. Por lo que se ha considerado la importancia de realizar modelos predictivos de riesgo que nos permitan desde la detección hasta el manejo oportuno de aquellas pacientes que presenten estos factores. Maitland y colaboradores realizaron un ensayo clínico controlado multicéntrico en el cual se sometió a 117 pacientes que se encontraban en su segundo trimestre de gestación con obesidad a un ensayo piloto intervencionista en el cual se les asignó una dieta específica y plan alimenticio (UPBEAT), se analizaron diversos biomarcadores entre ellos, adiponectina, leptina e insulina, encontrando que la presencia de hallazgos clínicos de riesgo más los niveles bajos de adiponectina en suero predicen de una manera más temprana y confiable el desarrollo de DG.62 El papel de la adiponectina en el embarazo no se limita únicamente al riesgo de resultados adversos maternos ya que se ha visto que se encuentra inversamente relacionada con el peso al nacer, a la medida de pliegues cutáneos y porcentaje de grasa en el recién nacido por lo que se ha propuesto que esta adipocina puede jugar un rol importante durante la regulación del crecimiento fetal participando en la homeostasis de glucosa materna, así como en el transporte placentario de nutrientes. De la misma manera, se ha propuesto el análisis de biomarcadores como la proteína C reactiva ultra sensible en conjunto con los niveles de adiponectina para evaluar riesgo posterior de DM2 cuando ya se presentó DG, así lo demuestra Kim y colaboradores en un análisis de un estudio de cohortes multicéntrico de pacientes obesas y con intolerancia a la glucosa así como pacientes sin DG comparando biomarcadores al inicio y después de 1 año de estudio encontrando niveles de adiponectina baja y PCR ultra sensible alta en aquellas pacientes con DG, las mismas que después de someterse a cambios en el estilo de vida presentaron disminución de adiponectina, PCR, fibrinógeno y factor activador tisular del plasminógeno, además encontraron que las pacientes que utilizaron metformina independientemente del diagnóstico de DG tuvieron disminución importante de PCR y factor activador de plasminógeno tisular.63 Además, se ha encontrado que los niveles altos de PCR ultra sensible aumentan hasta 1.8 veces más la probabilidad de requerir manejo farmacológico durante el embarazo.64 La hipoadiponectinemia es una característica crónica que desarrollan las pacientes con DG, en consecuencia, encontrarla en el primer trimestre de gestación pudiera predecir el desarrollo de DG durante el segundo o tercer trimestre de embarazo, además es un predictor independiente de resistencia a la insulina postparto, disfunción celular y glucemia en ayuno.65 La relación de leptina/adiponectina alta en mujeres con DG se ha asociado con un factor de riesgo cardiovascular desfavorable en el seguimiento posparto y la hipoadiponectinemia en el embarazo se ha sugerido como un posible factor contribuyente para otras patologías maternas como lo es la preeclampsia, lo cual estaría asociado con un aumento en el riesgo cardiovascular futuro.66 Se ha encontrado que los niveles de adiponectina plasmática están relacionados inversamente con la intensidad de la lactancia en mujeres con DG y se sugiere que existen mecanismos hormonales que participan en este proceso regulando la adiponectina independientemente de la obesidad y la resistencia a la insulina.67 Se ha propuesto incluir en el manejo de pacientes con hipoadiponectinemia el uso de sustancias que aumenten los niveles de adiponectina en pacientes con DG tal es el caso del extracto de Artemisia el cual, se ha encontrado que aplicado durante el segundo trimestre de gestación mejora el metabolismo de la glucosa y la sensibilidad a la insulina en pacientes con DG, así como también aumenta los niveles de adiponectina sérica.68
CONCLUSIONES
Después del análisis de los reportes científicos para esta revisión de los últimos 10 años sobre la regulación de adiponectina y sus implicaciones clínicas, podemos decir que los efectos benéficos de la adiponectina sobre el metabolismo de la glucosa y la sensibilidad a la insulina a nivel hepático y muscular están descritos, sin embargo, existen múltiples factores que pueden explicar investigaciones con resultados opuestos o sin los efectos esperados. En este sentido, destacamos la necesidad de evaluar las isoformas de adiponectina para explicar la diferencia entre el estado metabólico de pacientes con la misma condición, cómo podría ser DG. Por otro lado, las variantes genéticas del gen ADIPOQ han sido asociadas positivamente con los niveles circulantes, mejoras en la sensibilidad a la insulina o menor IMC en pacientes que han participado con intervención dietética o ejercicio. Particularmente, se ha observado que la modulación de la expresión de adiponectina a nivel transcripcional y proteico se ve influenciada por el consumo de ácidos grasos poliinsaturados y ejercicio de alta intensidad. Además, existe evidencia de que las intervenciones nutricionales aunado a la suplementación con probioticos podrían incrementar los niveles de adiponectina en leche materna, lo que resalta la importancia de la nutrición en el embarazo. En los modelos que se han considerado variables clínicas, antropométricas y la propia adiponectina se consideran predictores con alto potencial para evaluar el riesgo de desarrollar DG. Asimismo, la relación con otras adipocinas, como la fracción adiponectina/leptina podrían predecir el riesgo de desarrollar obesidad y diabetes en recién nacidos.
De acuerdo con lo anterior podemos concluir que:
Referencias