Rev Med UAS
Vol. 12: No. 3. Julio-Septiembre 2022
ISSN 2007-8013
Amairani Tanairi Rodríguez-de la Vega1, Jesús Ramón Alvarez-Félix2, Alma Marlene Guadrón-Llanos3, Efraín Romo-García4, Javier Abdenego Magaña-Gómez5, Carla Ernestina Angulo-Rojo3*
* Correspondencia: Dra. Carla Ernestina Angulo-Rojo
Ave. Sauces S/N. Fracc. Los Fresnos. C.P. 80019. Culiacán, Sinaloa.
Correo: carla.angulo@uas.edu.mx
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v12.n3.006
Texto Completo PDFRecibido 23 de febrero 2021, aceptado 10 de enero 2022
RESUMEN
Objetivo: La enfermedad de ojo seco es una patología multifactorial, de la superficie ocular y lágrima, que provoca un cuadro clínico con alteración fluctuante de la visión y una película lagrimal inestable con potencial daño a la superficie ocular. Los microRNAs representan una familia recientemente descubierta, formada por ARN con longitud de 18 a 25 nucleótidos. --- Objetivo: caracterizar el patrón de expresión de miR-34, miR-106 y miR-184 en la enfermedad de ojo seco multifactorial, para evaluar su potencial como biomarcadores. --- Material y metodos: estudio observacional, transversal, descriptivo y prospectivo en pacientes con enfermedad de ojo seco respecto a pacientes sanos, donde se cuantificó la expresión de tres microRNAs. A cada paciente incluido en este estudio se le realizó exploración oftalmológica, evaluación clínica, toma de muestra sanguínea y de lágrima para análisis y cuantificación de microRNAs mediante técnica RT-PCR, con método de Pfaffl. --- Resultados: se encontró sobreexpresión de miR-106 en suero, con tasa de cambio 2 veces mayor, y sobreexpresión de miR-184 en lágrima, con tasa de cambio 3 veces más, respecto a grupo control, estadísticamente significativos. Conclusión: nuestros resultados sugieren que dos microRNAs medidos podrían estar implicados en la fisiopatología de enfermedad de ojo seco, de manera sistémica (miR-106) y de manera localizada (miR184). Sin embargo, dada la complejidad de estas vías moleculares, se dificulta la delimitación de su papel en la fisiopatología de esta enfermedad, motivo por el cual se necesitan más estudios, para validar su papel como biomarcadores diagnósticos tempranos para detección de enfermedad de ojo seco.
Palabras clave: microRNAs, RT-PCR, lágrima, ojo seco.
Abstract
Dry eye disease is a multifactorial disease of the ocular surface and tear, which causes a clinical presentation of ocular symptoms and signs, with fluctuating vision impairment and an unstable tear film with potential damage to the ocular surface. MicroRNAs represent a recently discovered family made up of small RNAs, 18 to 25 nucleotides in length. Objective: to characterize the expression pattern of miR-34, miR-106 and miR-184 microRNAs in multifactorial dry eye disease, to evaluate their potential as biomarkers. Material and methods: observational, cross-sectional, descriptive and prospective study in patients with dry eye disease compared to healthy patients, where the expression of three microRNAs was quantified. Patients included in this study underwent an ophthalmological examination and clinical evaluation, blood and tear sampling for analysis and quantification of miRNAs by RT-PCR technique, with the Pfaffl method. Results: overexpression of miR-106 was found in serum, with a rate of change 2 times more compared to the control group. And overexpression of miR-184 in tears, with a rate of change 3 times more, compared to the control group, both statistically significant. Conclusion: our results suggested that miR-106 and miR-184 could be involved in the pathophysiology of dry eye disease, systemically (miR-106) or locally (miR184). However, it is difficult to define the role of microRNAs in the pathophysiology of dry eye disease, the main reason why larger studies are needed for a better exploration of these molecular pathways, and thus validate their role as early diagnostic biomarkers for the detection of dry eye disease.
Key words: microRNA, RT-PCR, tear, dry eye.
INTRODUCCIÓN
La enfermedad del ojo seco es una patología multifactorial, muy común y difícil de controlar, se estima una afectación aproximada del 7.4% al 33.7% de la población, aumentando esta prevalencia con la edad. Esta afección disminuye la calidad de vida de las personas que la padecen, ya que produce incomodidad ocular y deterioro visual temporal, esto ha llevado a formar más conciencia sobre la repercusión de esta patología en la vida diaria del ser humano, y enfatizar en el diagnóstico oportuno y el buen control de la misma.1
La Sociedad de superficie ocular y película lagrimal (TFOS) – segundo taller de ojo seco (DEWS II), fue la primera organización en reconocer como “Enfermedad” al ojo seco, e incluir alteraciones visuales a sus manifestaciones, y fue en el año 2007 cuando la definió como:
“Enfermedad multifactorial, tanto de la superficie ocular como de la lágrima, que provoca un cuadro clínico compuesto por síntomas y molestias oculares, alteración fluctuante de la vista, y una película lagrimal inestable con potencial daño a la superficie del ojo”.2
Es una enfermedad de carácter crónico y de gran impacto económico, aunque no se cuenta con un estimado exacto, genera gastos tanto directos en el alto costo de medicamentos y visitas médicas, como indirecto ya que disminuye la productividad y reduce la calidad de vida. Su prevalencia variable es dependiente de las pruebas diagnósticas utilizadas, el rango de edad de los pacientes estudiados y zonas geográficas elegidas, se necesitan más estudios para conocer datos epidemiológicos más concretos sobre esta patología.3
La triada fisiopatológica que facilita la aparición de ojo seco engloba: inestabilidad de la película lagrimal, hiperosmolaridad de la lágrima e inflamación de la superficie ocular. Todo esto ocasiona estrés en la superficie ocular, promoviendo la liberación de citocinas proinflamatorias, quimiocinas y metaloproteinasas de la matriz, con la siguiente infiltración de linfocitos T en la superficie ocular y glándulas lagrimales, resultando en un círculo vicioso que da como resultado un daño e inflamación a la superficie del ojo, agravando y perpetuando la enfermedad.4
La clasificación de la enfermedad de ojo seco continúa siendo la misma desde 1995, cuando el Instituto Nacional del Ojo la categorizo en dos tipos según su fisiopatología, aunque pueden coexistir y dar lugar a un componente mixto: por deficiencia de la capa acuosa, que a su vez se divide en dos tipos; Síndrome de Sjögren y Síndrome no Sjögren (ojo seco típico, una variante de ojo seco por deficiencia acuosa). Y ojo seco evaporativo.5
El cuadro clínico está compuesto por una gama inconsistente de signos y síntomas oculares, entre ellos: sensación de cuerpo extraño ocular, dolor ocular, hiperemia conjuntival, fatiga ocular, agudeza visual fluctuante y el síntoma que más deteriora la calidad de vida en estos pacientes es el dolor neuropático corneal (referido como dolor sordo, ardoroso y agudo), ya que según encuestas realizadas, estos pacientes califican el impacto deletéreo en la calidad de vida ocasionado por la enfermedad de ojo seco como similar al que ocasiona la angina de pecho y diálisis hospitalaria.6
El diagnóstico de ojo seco implica una correlación de síntomas y signos que pueden ser evaluados subjetiva y objetivamente. Sin embargo dada la naturaleza inconsistente del cuadro clínico de esta enfermedad no siempre los síntomas corresponden con exactitud con los signos clínicos medibles con estas pruebas. Dentro de las pruebas subjetivas, encontramos: historia clínica y evaluación del cuadro clínico del paciente, cuestionarios certificados para enfermedad de ojo seco (Test de OSDI). Respecto a pruebas objetivas, las más utilizadas son: medición del menisco lagrimal, test de Schirmer, medición del tiempo de ruptura de película lagrimal (Break – up time), medición del espesor lagrimal, evaluación de las glándulas de meibomio, osmolaridad lagrimal, tinción epitelial de la superficie ocular y tomografía de coherencia óptica de segmento anterior (OCT, por sus siglas en inglés).7, 8.
El manejo de la enfermedad de ojo seco es complicado, individualizado, multi-intervencionista y de elevado costo. Si bien los síntomas y signos mejoran con el tratamiento adecuado, no es totalmente curable, pero su objetivo es mejorar la calidad de vida de los pacientes. Cada una las terapias son utilizadas según la gravedad de la enfermedad, existiendo así pacientes con ojo seco leve en el cual las lágrimas artificiales son suficientes para la mejoría clínica, y el extremo del paciente con enfermedad grave que necesita un tratamiento más agresivo y poli farmacológico, aun sin mejoría de la enfermedad. Las opciones de tratamiento incluyen: medidas de higiene ocular, sustitutos de lágrimas artificiales, terapia antiinflamatoria (corticoesteroides tópicos, ciclosporina A tópica, terapia hormonal, antibióticos), ácidos grasos esenciales, suero autólogo, lentes de contacto de hidrogeles, extracto de membrana amniótica, tratamiento quirúrgico de los parpados (tarsorrafia), uso de toxina botulínica en musculo orbitario y sustitución protésica de los ecosistemas de la superficie ocular.9
Es frecuente encontrar una mayor afectación en pacientes adultos, predominando en el sexo femenino, así como es muy común que se encuentre asociada a otras enfermedades oculares como glaucoma, conjuntivitis alérgica, queratoconjuntivitis, blefaritis, así como enfermedades autoinmunes como artritis reumatoide, lupus eritematoso sistémico, esclerosis múltiple, psoriasis, entre otras. Por ello es importante buscar intencionadamente signos y síntomas clínicos sugestivos de enfermedad de ojo seco en cualquier enfermedad autoinmune, para tratar oportunamente el cuadro y ofrecer una mejor calidad visual al paciente.10
La artritis reumatoide es una enfermedad sistémica de carácter inmunológico, crónica. Afecta a 0.5 a 1% de la población a nivel mundial. Es de las patologías que más comúnmente coexisten con enfermedad de ojo seco, en su variante síndrome de Sjögren, dada su similitud fisiopatológica, ya que en ambas existe una ruptura de la tolerancia inmune y un proceso inflamatorio. En un estudio realizado por Andonopoulos et al se estimó que 5% de los pacientes con artritis reumatoide tienen manifestaciones de síndrome de Sjögren sin padecer la enfermedad.11
En la última década se ha investigado el papel de los microRNAs (miRNAs, por sus siglas en inglés) en la regulación de la respuesta inmune, asociando la expresión de estas moléculas a la inflamación de tejidos como la glándula salival en pacientes con síndrome de Sjögren, donde el ojo seco se manifiesta secundariamente.
El primer microRNA descubierto fue en el año de 1993, por Lin-4. Los microRNAs representan una familia recientemente descubierta formada por ARN pequeños, con una longitud de 18 a 25 nucleótidos. Estos se transcriben a partir de genes de DNA, pero no se traducen a proteínas, es decir son genes no codificantes. La mayoría de ellos se ubican en regiones intergénicas y tienen su propio promotor y elementos reguladores. El 40% de ellos están ubicados en intrones y se transcriben en el gen hospedador. Tienen un papel importante en la regulación de la expresión del genoma a nivel postranscripcional por medio de degradación e inhibición de traducción de sus miRNAs dirigidos, regulando con esto múltiples procesos biológicos, como; metabolismo, desarrollo, sistema inmunológico y el desarrollo de patologías.12,13
Representan el 1-5% del genoma del ser humano, los cuales pueden regular aproximadamente 30-40% de los genes que codifican proteínas a nivel postranscripcional. Desempeñan un papel fundamental en el control diversos procesos biológicos e inmunológicos. Los pequeños RNA se pueden encontrar en prácticamente todos los biofluidos humanos, entre los que destacan el suero y lágrima, por ser asequibles con procesos mínimamente invasivos. Sus niveles circulantes, así como su desregulación se asocian con una diversidad de enfermedades, como trastornos metabólicos, trastornos del sistema nervioso central y enfermedades autoinmunes.14
Los microRNAs funcionan como reguladores de la proliferación y diferenciación de las células madre, así como apoptosis. Es de esperarse que las alteraciones en estos pequeños RNA estén altamente relacionados con ruptura de la tolerancia inmune que lleva al desarrollo de disfunciones inmunológicas y trastornos de la autoinmunidad, y por lo tanto su expresión seria de ayuda para identificarlos como biomarcadores asociados a cierta enfermedad auto inmunológica principalmente.
El descubrimiento y mayor estudio de los miRNAs como moduladores de la expresión del genoma nos ayudaría a detectar predisposición para presentar ciertas enfermedades, sobre todo autoinmunitarias como enfermedad de ojo seco, con sus variantes síndrome de Sjögren, o asociado a enfermedades autoinmunes como artritis reumatoide, esclerosis múltiple, psoriasis, lupus eritematoso sistémico y muchas otras, con el objetivo de identificarla antes de su desarrollo, y con ello poder otorgar un manejo oportuno y adecuado individualizado a cada paciente.15,16
Con base en un análisis de las publicaciones científicas donde se han evaluado la expresión de miRNAs en enfermedad de ojo seco principalmente con etiología SS; basados en la frecuencia de alteración, se eligieron 3 microRNAs, miR34, miR-106 y miR-184, para ser analizados y cuantificados en lágrima y suero de pacientes con enfermdad de ojo seco multifactorial respecto a población sana.
MATERIAL Y MÉTODOS
Es un estudio observacional, transversal, descriptivo y prospectivo, que se llevo a cabo en el departamento de oftalmología del Hospital Civil de Culiacán, CIDOCS, se incluyeron pacientes diagnosticados como sanos oftalmológica y sistémicamente, así como aquellos con datos clínicos compatibles con enfermedad de ojo seco, mediante exploración clínica y oftalmológica completa, test para ojo seco (OSDI), pruebas diagnósticas mencionadas (test de Schirmer y tiempo de ruptura de película lagrimal) e interrogatorio dirigido, durante el tiempo comprendido entre el 01 de septiembre de 2020 al 01 de diciembre de 2020.
El tamaño de muestra total fue de 40 individuos, distribuidos 20 individuos en cada grupo de estudio, pacientes sanos como grupo control y pacientes con enfermedad de ojo seco, para el grupo problema. A cada paciente se tomaron 10 ml de muestra sanguínea (un tubo purpura y un tubo amarillo) y 50 microlitros de muestra de lágrima, para caracterizar el perfil de expresión de los microRNAs miR-34, miR-106 y miR-184, y tratar de evaluar su potencial como biomarcadores en la enfermedad de ojo seco multifactorial.
Los criterios de inclusión planteados para dicha investigación, fueron: pacientes mayores de 18 años de edad, ambos sexos, con diagnóstico de enfermedad de ojo seco para el grupo problema, sanos oftalmológica y sistémicamente para el grupo control, que aceptaran y firmar el consentimiento informado para el ingreso al estudio, así como la toma de muestra sanguínea y muestra de lágrima para procesamiento, análisis y resguardo de las mismas. Los criterios de exclusión para esta investigación fueron solo dos, que presentaran alguna patología si se incluiria en el grupo control o que no aceptaran participar en el estudio.
La cuantificación de los microRNAs en lágrima y sangre se llevó a cabo en el laboratorio de Neurociencias de la Facultad de Medicina de la Universidad Autónoma de Sinaloa, de la siguiente manera: la lagrima se almaceno a -20°C hasta su procesamiento, al ser un fluido con muy bajo contenido de proteínas, lípidos y carbohidratos que interfieran con las reacciones de retro transcripción (RT) no se procedió a realizar purificación de microRNAs. Los miRNAs presentes en la lágrima fueron convertidos a cDNA mediante el sistema miScript II RT kit (QIAGEN, Hilden, Germany), el cual utilizó oligos dT y Hispec buffer para la identificación de miRNAs maduros a partir de una incubación de 37°C durante 60 minutos y 90°C durante 5 minutos. La Retro-transcripción - Reacción en cadena de polimerasa (PCR) en tiempo real fue procesada en el equipo StepOne Plus (Thermo Fisher Scientific, MA, USA). El cDNA obtenido se cuantificó mediante qPCR utilizando el sistema mi Script SYBR Green PCR (QIAGEN, Hiden, Germany), se emplearon los ensayos para el miRNA-146 de Qiagen, Hiden, Germany. Como control constitutivo se utilizó el ensayo del RNA pequeño nucleolar 68 SNORD68 (No. Cat. 00033712). Se utilizó como control negativo un templado sin cDNA. Las reacciones de qPCR de los miRNAs se realizaron en el termociclador tiempo real StepOnePlus (Thermo Fisher Scientific, MA, USA). Aunado a lo anterior, se desarrolló una curva de disociación de melting (Melt Curve) para demostrar la especificidad de la reacción, las cuales, se hicieron por triplicado.
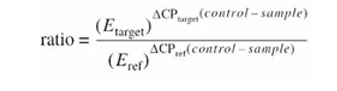
La cuantificación relativa se realizó mediante el método Pfaffl, el cual se basó en las eficiencias de la muestra problema y la muestra control. Para obtener el cálculo de dichas eficiencias, se utilizó el software LinRegPCR, a partir de la fase exponencial de la fluorescencia (Ruijter y cols., 2009). Por último, se realizó una regresión lineal de al menos 4 puntos de datos, donde la pendiente de la línea de la regresión representó la eficiencia de la PCR (Pfaffl, 2001).

Para el análisis estadístico primero, se comprobó sí los datos obtenidos presentaron una distribución normal mediante la prueba de Kolmogorov-Smirnov. Se calculó la media ± desviación estándar, como valor estándar de los datos descriptivos para cada individuo y para la diferencia de las medias obtenidas se utilizará la T-student y para las medianas y la mediana de la tasa de cambio, se utilizó la prueba de Mann-whitney. Se determinó la correlación con la prueba Spearman. Dicho análisis estadístico se realizó en el programa GraphPad prism, donde los valores de P <0.05 se consideraron para la significancia estadística.
RESULTADOS
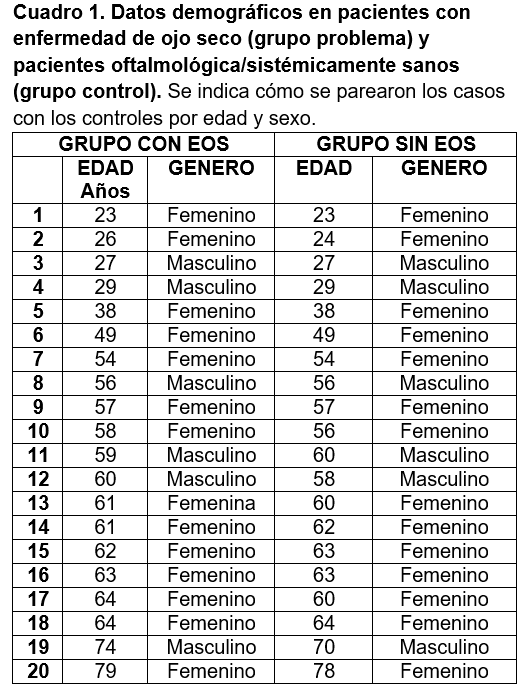
En el presente estudio se incluyeron 40 pacientes en total para toma de muestra de lagrima y sangre, 20 pacientes con diagnóstico de enfermedad de ojo seco se incluyeron en el grupo con EOS, y los 20 pacientes restantes se incluyeron en el grupo de control, por ser conocidos sanos oftalmológica y sistémicamente (cuadro 1).
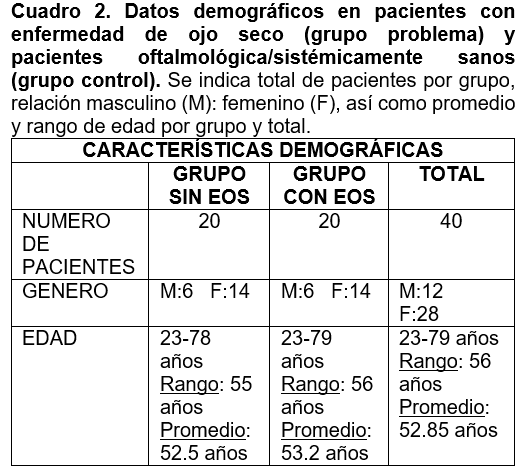
El promedio de edad para el grupo sin EOS fue de 53.2 años, en el grupo control fue 52.5 años. Respecto al sexo biológico, hubo un porcentaje mayor de mujeres incluidas en el estudio, con una relación hombre: mujer individual para cada grupo 6:14, lo que sesgaría la prevalencia de enfermedad de ojo seco en este estudio (cuadro 2). Sin embargo al comparar ambos grupos, los datos fueron homogeneos entre si y no existió diferencia significativa entre la edad y género de los pacientes.
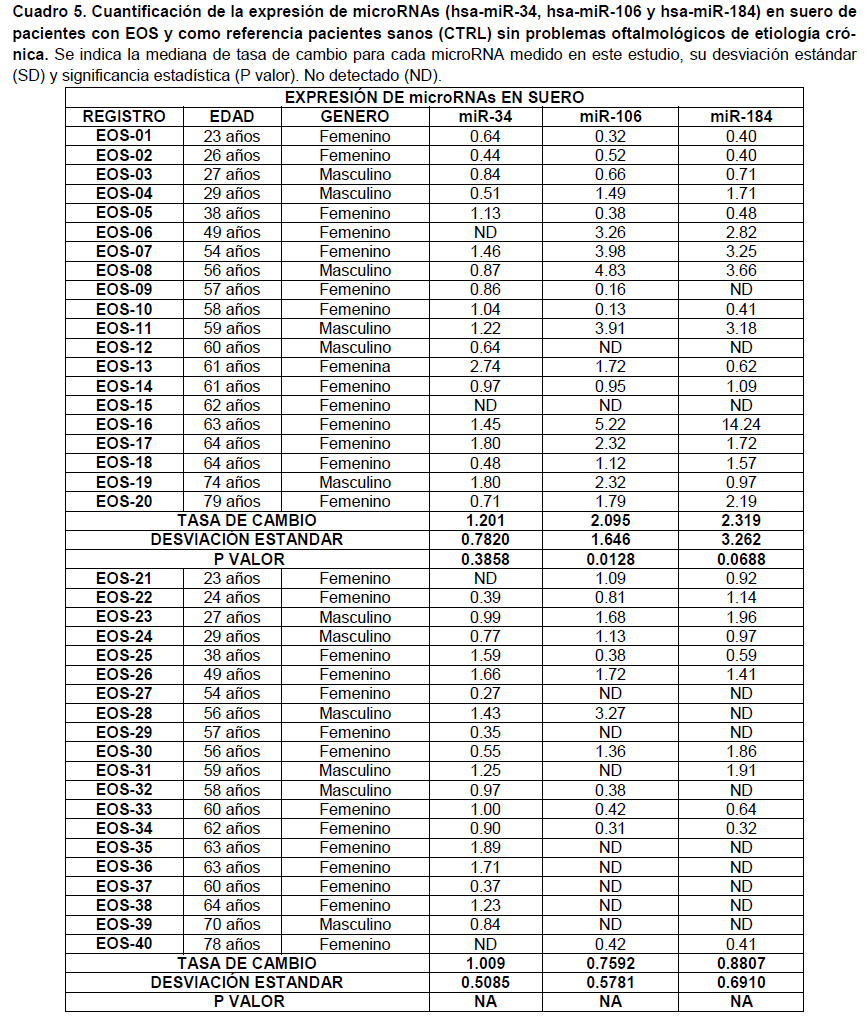
Se cuantifico la expresión de tres microRNAs (hsa-miR-34, hsa-miR-106 y hsa-miR-184) en lágrima y suero de pacientes con EOS y como referencia pacientes control (CTRL) sin problemas oftalmológicos de etiología crónica (Cuadro 3,4 y 5).
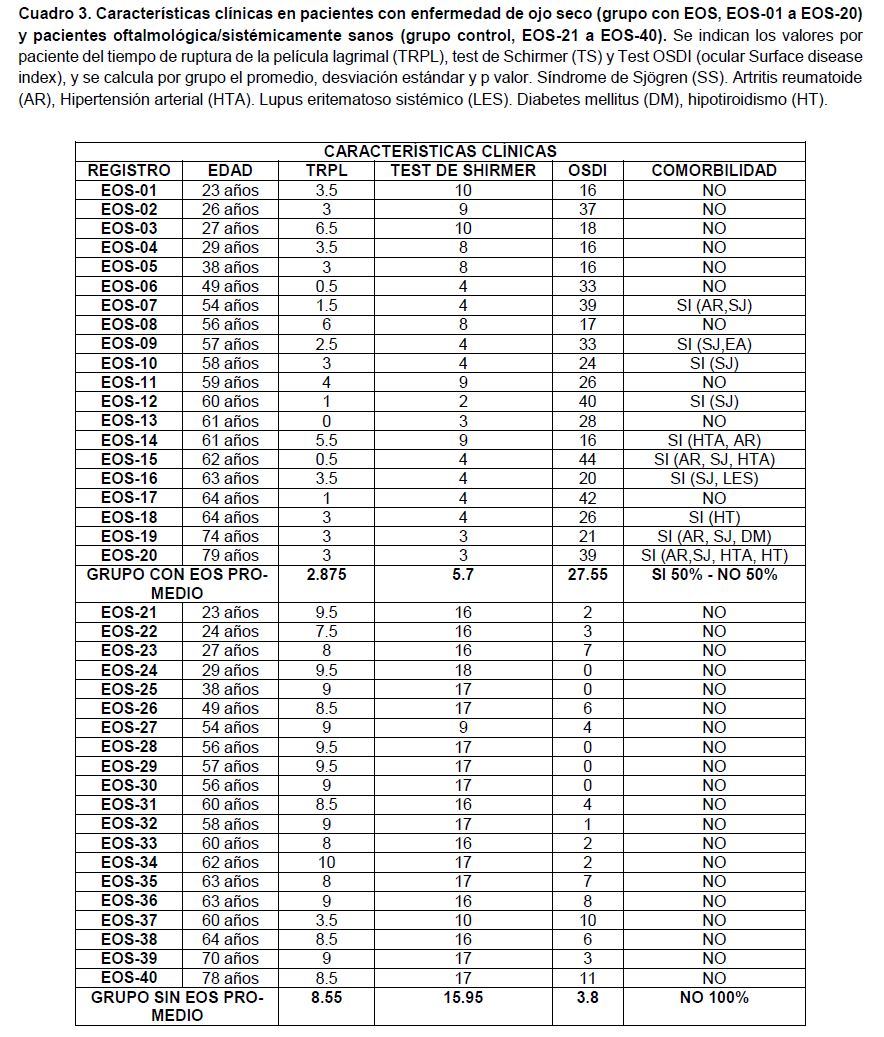
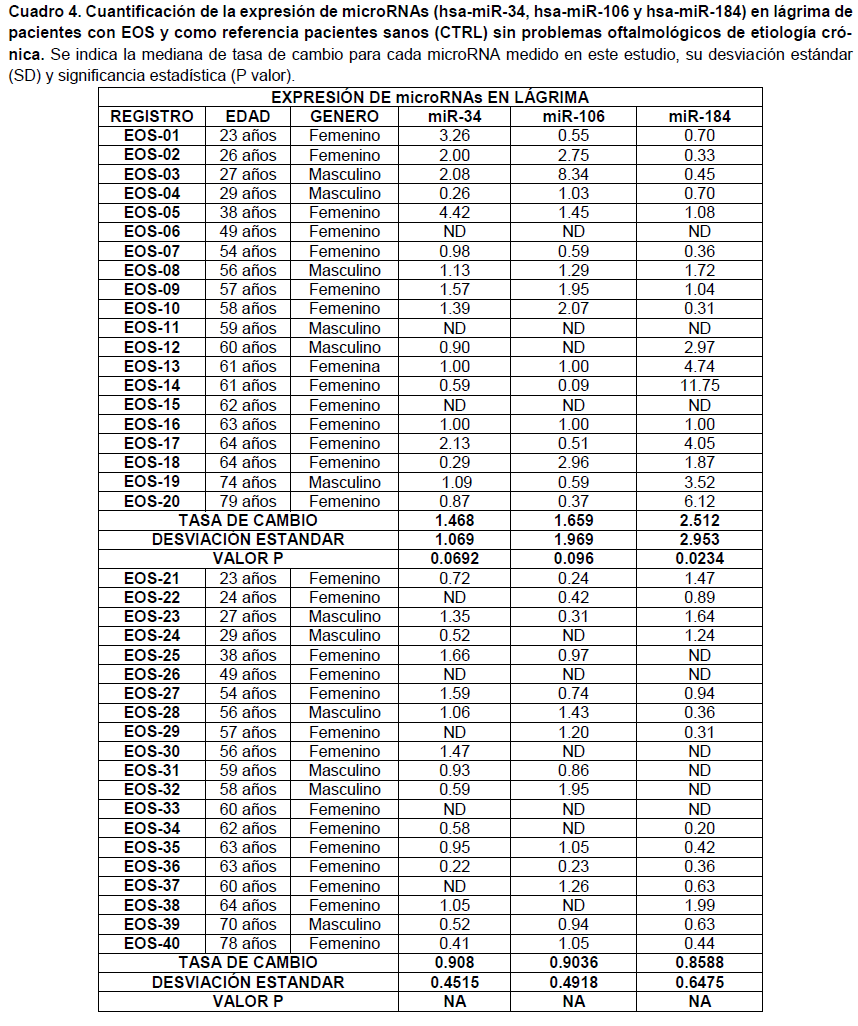
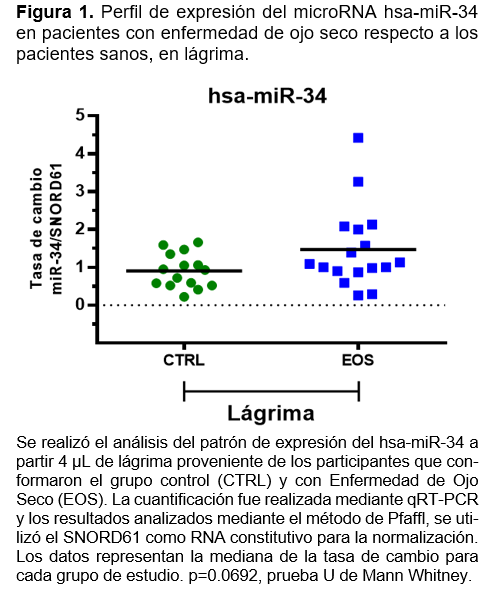
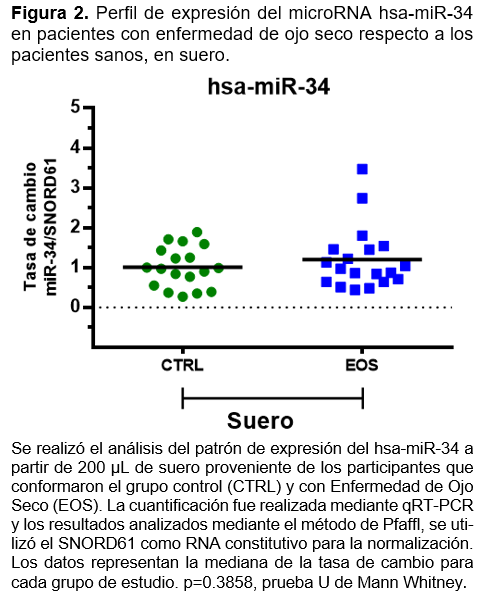
En la cuantificación y análisis en lágrima y suero para miR-34, aunque se observa una tendencia de sobre expresión en la población con EOS, con pacientes con una tasa de cambio de hasta 4 veces más respecto al CTRL, no resultó estadísticamente significativo (Figuras 1 y 2). Es probable que en el caso de miR-34, los cambios en el perfil de expresión sean menos sensibles y requiera un análisis con un número de población más grande.
Respecto a miR-106, se observa que en el suero de los pacientes con EOS, se tiene una tasa de cambio con sobre expresión para miR-106 de aproximadamente 2 veces más respecto a los pacientes CTRL, siendo estadísticamente significativo con un valor p=0.0128 (Figura 4). En el análisis de muestra de lágrima, aunque se observa una tendencia similar al perfil de expresión para miR-106 observado en suero, no resultaron estadísticamente significativas (Figura 3).
Finalmente, en la cuantificación y análisis para miR-184, se observó que en lágrima de los pacientes con EOS, se tiene una tasa de sobre expresión de aproximadamente 3 veces más respecto a los pacientes CTRL, siendo estadísticamente significativo con un valor p=0.0234 (Figura 5). En el análisis de muestra de suero, aunque se observa una tendencia similar al perfil de expresión para miR-184 observado en lágrima, no se resultó estadísticamente significativo (Figura 6, cuadro 5).
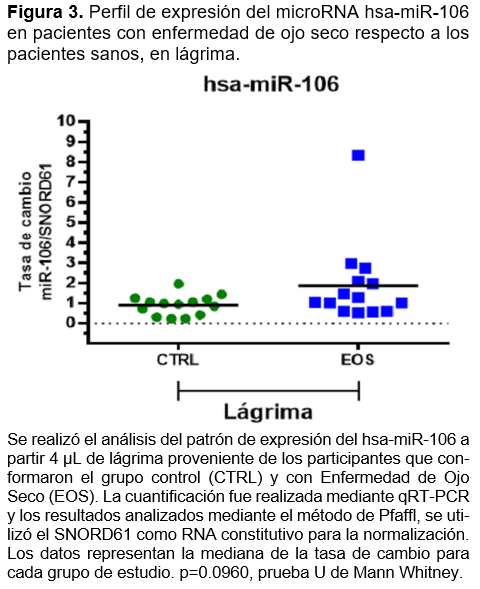
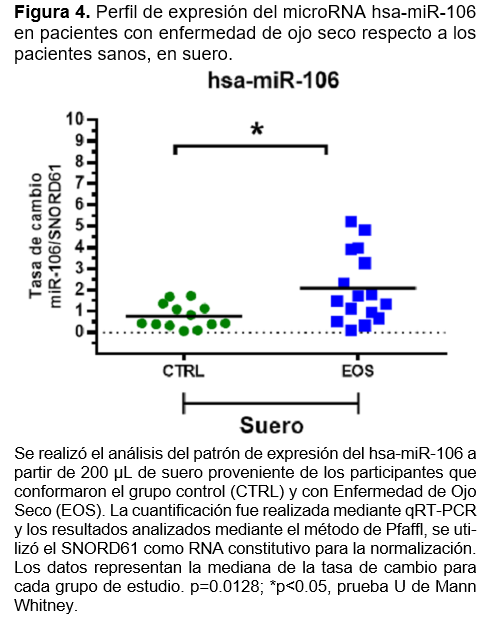
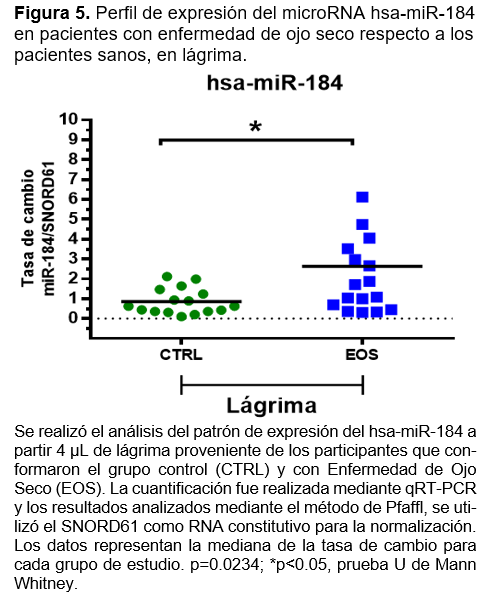
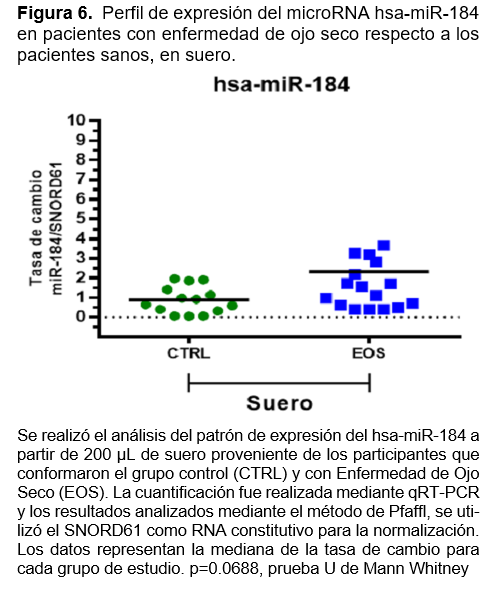
En conjunto estos resultados sugieren que los microRNAs miR-106 y miR-184 podrían estar implicados en la fisiopatología de enfermedad de ojo seco de manera sistémica (miR-106) o de manera localizada (miR184). Además, monitorear cambios en la expresión de miR-106 en sangre periférica y de miR-184 en lágrima, puede ser propuesto como biomarcadores de la enfermedad de ojo seco, siendo necesario un estudio más profundo que sustente esta propuesta.
DISCUSIÓN
La enfermedad de ojo seco una patología multifactorial, muy común y de difícil manejo, con una afectación estimada del 5-50% de la población, aumentando esta prevalencia con la edad.7,8
Su relación con otros padecimientos oftalmológicos se ha estudiado previamente en múltiples ocasiones. El reto médico es el tratamiento óptimo e individualizado para mejorar la calidad de vida de estos pacientes, ya que, si bien con tratamiento existe mejoría sintomática, no es una enfermedad curable. Cada una las terapias son utilizadas según la gravedad de la enfermedad, la cual varia ampliamente entre los pacientes sin tener una base científica clara del porqué. Existiendo así, pacientes con enfermedad de ojo seco leve en el cual las lágrimas artificiales son suficientes para la mejoría clínica, y el extremo del paciente con enfermedad grave que necesita un tratamiento más agresivo y poli farmacológico, aun sin mejoría de la enfermedad.9
Ante este panorama, es necesario disponer de biomarcadores que puedan ser obtenidos de manera no invasiva y que puedan aportar en la mejora de un diagnóstico más preciso y temprano de la patología.
Muchos estudios han demostrado la presencia de citoquinas pro inflamatorias en lagrima y suero de pacientes con variedades de enfermedad de ojo seco13, pero son pocos los que han cuantificado la expresión de microRNAs, y solo 1 estudio el que ha comparado la expresión de estos biomarcadores en lágrima en pacientes con enfermedad de ojo seco y pacientes sanos.
Algunos estudios informaron la sobreexpresión de miR-146a y miR-155 en las células mononucleares de sangre periférica de pacientes con síndrome de Sjögren primario
Gourzi et al. Identificaron en su estudio los siguientes microRNAs sospechosos de dirigirse a los mRNA de Ro/SSA y La/SSB en síndrome de Sjögren primario: miR-16, miR-181a, miR-200b-3p, miR-200b-5p, miR-223 y miR483-5p. Distribuidos de la siguiente manera: sobreexpresión de miR-16 en glándulas salivales menores, miR-200b-3p en células epiteliales de glándulas salivales y miR-223 en conjunto con miR-483-5p en células mononucleares de sangre periférica de pacientes con síndrome de Sjögren en comparación con los de los de síndrome sicca.
Varios estudios han examinado la expresión de microRNA en suero, glándulas salivales o células epiteliales de glándulas salivales de pacientes con síndrome de Sjögren, así como en otras enfermedades autoinmunes como artritis reumatoide, lupus eritematoso sistémico, esclerosis sistémica, psoriasis y esclerosis múltiple, entre otras; sin embargo, ninguno ha investigado la expresión de microRNAs en lagrima y suero de pacientes con enfermedad de ojo seco perse y aún menos compararlo con un grupo control de pacientes sin enfermedades sistémicas ni oftalmológicas de naturaleza crónica.12-15
Siendo la lágrima parte fundamental de esta enfermedad de ojo seco, podría actuar como biomarcadores de esta patología. El análisis de cambios en los componentes bioquímicos en lágrima podría proponerse como un método diagnóstico temprano, molecular y no invasivo en EOS, ya que contiene todas las proteínas, lípidos, aminoácidos, metabolitos y microRNAs presentes en la superficie ocular y proveniente de las glándulas lagrimales.
El presente estudio aporta evidencia sobre el potencial de estos microRNAs como biomarcadores para EOS, al brindar un análisis cuantitativo de la expresión de hsa-miR-34, hsa-miR-106 y hsa-miR-184 en lagrima y suero de pacientes con enfermedad de ojo seco y compararla con pacientes sin problemas sistémicos u oftalmológicos de etiología crónica, evaluando si existe mayor tasa de cambio de dichos microRNAs en pacientes con enfermedad de ojo seco.
En la cuantificación y análisis en lágrima y suero para miR-34, se observó una tendencia de sobre expresión en la población con EOS, con una tasa de cambio de hasta 4 veces más respecto al CTRL, que no resultó estadísticamente significativo. Estos cambios en el perfil de expresión se muestran menos sensibles y requieren un análisis con un número de población más grande para realizar estimaciones más exactas. Este resultado encontrado en nuestro estudio es compatible con la sobreexpresión de mir-34 encontrada en suero de pacientes con síndrome de Sjögren descrita por Ji-Qing Chen y colaboradores15. Así como también se correlaciona con el resultado de Yu Jeong Kim y colaboradores, en donde mir-34 es regulado a la alza en lágrima de pacientes con enfermedad de ojo seco comparado con pacientes sanos.17
En cuanto a miR-106, se observa que en suero de los pacientes con EOS, se tiene una tasa de cambio con sobreexpresión para miR-106 de aproximadamente 2 veces más respecto a los pacientes CTRL, siendo estadísticamente significativo con un valor p=0.0128, valores no descritos en pacientes con EOS en otros estudios revisados. En el análisis de muestra de lágrima, se observa una tendencia similar al perfil de expresión para miR-106 observado en suero, pero no resultaron estadísticamente significativas. M. Reale y colaboradores han encontrado valores similares de sobreexpresión de mir-106 en pacientes con síndrome de Sjögren, en quienes se ha analizado secreción de glándulas lagrimales menores, no siendo significativo, ya que mismos valores coinciden con otras enfermedades autoinmunes.18
Finalmente, en la cuantificación y análisis para miR-184, se observó que en lágrima de los pacientes con EOS, se tiene una tasa de sobreexpresión de aproximadamente 3 veces más respecto a los pacientes CTRL, siendo estadísticamente significativo con un valor p=0.0234. Sin embargo ha sido descrito por Diane Meyre Rassi y colaboradores, que miR-184 se expresa abundantemente en el tejido de la córnea, en comparación con otros tejidos, lo que podría influir en los niveles encontrados en lágrima de pacientes con EOS, ya que juega un papel clave en la córnea sana y en sus enfermedades. Diversos estudios de familias de diferentes partes del mundo mostraron que las mutaciones en el microRNA-184 provocan adelgazamiento de la córnea, que ha sido relacionado con ectasias corneales, principalmente queratocono. Por lo que faltan más estudios que busquen correlacionar los niveles de expresión de dicho microRNA en lágrima con ciertas patologías específicas, ya que el nivel de expresión de mir-184 suele ser alto en corneas sanas.17
En el análisis de muestra de suero, aunque se observa una tendencia similar al perfil de expresión para miR-184 observado en lágrima, no se resultó estadísticamente significativo. Hasta el momento no se han descrito niveles elevados de este microRNA en suero de pacientes con EOS, pero si se ha estudiado en otras patologías autoinmunes, como esclerosis múltiple, lupus eritematoso sistémico, psoriasis, entre otras. Ji-Qing Chen y colaboradores encontraron sobrexpresión de miR-184 en suero de pacientes con lupus eritematoso sistémico, pero en pacientes con EOS no fue detectado.15
En conclusión estos resultados sugieren que monitorear cambios en la expresión de miR-106 en sangre periférica y de miR-184 en lágrima, pudiera en un futuro ser propuesto como biomarcadores de la enfermedad de ojo seco, siendo necesario un estudio más profundo que sustente esta propuesta.
Los resultados obtenidos pueden abrir una pauta para nuevas investigaciones en las cuales se cuantifiquen y comparen estos biomarcadores en pacientes con enfermedad de ojo seco u otras enfermedades autoinmunitarias y pacientes sanos sistémica y oftalmológicamente, y así en un futuro, esté resultado, de ser sustentado por un estudio más profundo, otorgaría dos biomarcadores para enfermedad de ojo seco, el cual podría ser obtenido de manera no invasiva mediante el análisis de lágrima y suero, proporcionando así un método diagnóstico temprano para dicha enfermedad.
Sin embargo, el solo hecho de que los microRNAs séricos pueden ser liberados por cualquier célula del cuerpo hace que su especificidad como biomarcadores diagnostico se vea afectada. En cambio en el caso de la lágrima, que en su mayoría es liberada por un número limitado de glándulas “órgano diana afectado” podría en un futuro contribuir a una mayor.
Sin embargo nuestro estudio también tuvo varias limitaciones. La primera es que el número de muestra es pequeño en cada grupo lo cual puede ocasionar que la significancia estadística sea menor. Otra limitación es que el rango de edad por grupo es amplio, siendo de 56 años para el grupo casos y 55 años para el grupo control, con lo cual pudieran generarse números sesgados. Respecto al sexo biológico, hubo un porcentaje mayor de mujeres que de hombres incluidos en el estudio, con una relación hombre: mujer total de 28:12, desconociéndose si esta variable podría impactar a los niveles de estos biomarcadores en lágrima o suero, lo cual podría modificar los resultados obtenidos. Y finalmente la correlación entre el grado de inflamación ocular en la EOS y el nivel de expresión de hsa-miR-34, hsa-miR-106 y hsa-miR-184 en lágrima y suero no pudo investigarse con precisión.
REFERENCIAS