
Rev Med UAS
Vol. 12: No. 3. Julio-Septiembre 2022
ISSN 2007-8013
Martha Martínez-Salazar1a, Karina Juárez-González2b, José Juan Castillo-Pérez3c, Salvador Vázquez-Vega4d*
ahttps://orcid.org/0000-0002-5650-596X
bhttps://orcid.org/0000-0002-4017-8562
chttps://orcid.org/0000-0002-3725-3541
dhttps://orcid.org/0000-0001-7544-0906
* Correspondencia: Salvador Vázquez-Vega
Teléfono: (55) 23139112. Correo electrónico: salvazvega@gmail.com
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v12.n3.009
Texto Completo PDFRecibido 08 de octubre 2021, aceptado 08 de diciembre 2021
RESUMEN
Nunca antes en la historia de la ciencia, se había generado tanta información en tiempo real sobre un fenómeno de salud, como con la COVID-19. La forma de evaluación, abordaje, diagnóstico, tratamiento, prevención y detección de secuelas de esta enfermedad, desde su aparición hasta la publicación de este trabajo, ha sido cambiante. Los profesionales de la salud han enfrentado uno de los mayores retos en su quehacer, sobre todo en países como el nuestro, donde los sistemas de salud muestran tantos problemas. La revisión que a continuación presentamos se elaboró a partir de la consulta de diferentes bases de datos bibliográficas: Pubmed, Medline, Scopus, Lilacs, Science direct, Scielo, Ovid y páginas oficiales de la OPS (Organización Panamericana de la Salud), y de la OMS (Organiza-ción Mundial de la Salud) para contribuir con evidencia científica sobre las manifestaciones clínicas, diagnóstico y prevención de la COVID-19, y coadyuvar en el quehacer clínico.
Palabras clave: SARS-CoV-2/COVID-19; Síntomas/signos; Respuesta inmune; Secuelas; Factores de riesgo; Vacunas; Nuevas tecnologías.
Abstract
Never before in the history of science has so much information been generated in real time on a health phenomenon as with COVID-19. The way of evaluating, approaching, diagnosing, treating, preventing and detecting the sequelae of this disease, from its appearance until the publication of this work, has been changing. Health professionals have faced one of the greatest challenges in their work, espe-cially in countries such as ours, where health systems show so many problems. The following review was elaborated from the consulta-tion of different bibliographic databases: Pubmed, Medline, Scopus, Lilacs, Science direct, Scielo, Ovid and official pages of PAHO (Pan American Health Organization) and WHO (World Health Organization) to contribute with scientific evidence on the clinical mani-festations, diagnosis and prevention of COVID-19, and to contribute to clinical practice.
Key words:SARS-CoV-2; COVID-19; Symptoms/signs; Immune response; Sequelae; Risk factors; Vaccines; New technologies.
Definición de los términos:
IL= Interleucina, GM-CSF= Factor estimulante de colonias granulocítico-monocítico, IP-10= Proteína 10 inducible por interferón humano, MCP-1= Proteína quimioatrayente de monocitos-1, TNF= Factor de necrosis tumoral, %SpO2= Porcentaje de saturación de oxígeno en la sangre, PaO2/FiO2: índice [PaO2/fracción inspirada de oxígeno (FiO2)], usado comúnmente para definir lesión pulmonar aguda y síndrome de dificultad respiratoria, PEEP= Presión positiva al final de la expiración (técnica mecánica para ventilar a un paciente inconsciente, CPAP= Presión positiva continúa en la vía aérea.
Origen del SARS-CoV-2 y sus variantes
En enero del 2020, el examen de la secuenciación del genoma del agente causal de la neumonía severa que inició en Wuhan, China, dejó claro que se trataba de un nuevo coronavirus, cuyo nombre científico es SARS-CoV-2 (por sus siglas en inglés: severe acute respiratory syndrome) que ocasiona la afección conocida como COVID-19 1–3. Los análisis evolutivos demostraron su parentesco con otros virus cuyo hospedero primario son especies de murciélagos, proponiendo a estos animales como el reservorio original del SARS-CoV-2 4. Sin embargo, hasta el momento se desconoce el mecanismo completo de la transmisión a los humanos, aunque se sugiere que las alteraciones ambientales a nivel global, han contribuido a favorecer su adaptación al hombre; en ese sentido, el virólogo australiano Edward C. Holmes, indica que el proceso de evolución de un virus, es multifactorial, por lo que no se sabe con precisión cuándo se presentarán las mutaciones que permiten su fijación en una población 5,6. El genoma del SARS-CoV-2 contiene, en una molécula de RNA, cerca de 30,000 pares de bases y a medida que se replica, ocurren mutaciones. Los expertos estiman que la frecuencia de mutación para estos virus es de dos veces al mes, que comparado con otros virus, como los virus de la gripe o del VIH, es mucho menor 7,8. Al grupo de coronavirus con un mismo conjunto heredado de mutaciones distintivas se les llama linaje. Cuando las mutaciones en estos linajes, afectan su virulencia, letalidad, o antigenicidad, reciben el nombre de cepa o variante 9. Desde el inicio de la pandemia, se han generado variantes del SARS-CoV-2, y la OMS ha clasificado como variantes de preocupación (VOC por sus siglas en inglés), a aquellas que presentan una o más de las siguientes características: incremento en la capacidad de transmisión, aumento en su virulencia o disminución de la eficacia de las medidas de distanciamiento social, salud pública, diagnóstico, vacunas y terapéuticas disponibles. Además, clasifica a otras variantes como variantes de interés (VOI por sus siglas en inglés), que presentan: cambios fenotípicos y que se ha identificado que causan transmisión comunitaria, múltiples casos, conglomerados de casos, o se han detectado en diversos países. Desde el primero de junio de 2021, la OMS introdujo un sistema de nombres basado en letras griegas para la identificación de las variantes (Cuadro 1) 10,11.

Respuesta inmune contra el SARS-CoV-2
La infección por el virus SARS-CoV-2, puede provocar un síndrome respiratorio severo agudo, una respuesta hiper-inflamatoria característica, daño vascular, microangiopatía, angiogénesis y trombosis diseminada. El sistema inmune desempeña un papel muy importante en el combate contra la infección por este virus 9,12. Una vez que el virus infecta las células del huésped, se une al receptor de la enzima convertidora de angiotensina 2 (ECA2), localizado predominantemente en las células epiteliales alveolares tipo II de los pulmones 13,14, en células del tejido cardíaco, células del epitelio intestinal, en el endotelio vascular, en células renales y en células hematopoyéticas (incluidos monocitos, macrófagos y células dendríticas) 13. Una vez dentro de las células, el virus toma el control de la maquinaria celular y se multiplica, induciendo una respuesta inmune local, con activación de macrófagos y monocitos para responder a la infección. En la mayoría de los casos la respuesta inmune que sigue a la infección viral cede, y los pacientes se recuperan. Sin embargo, en los casos severos, la respuesta inmune se torna disfuncional, con infiltración masiva de células inflamatorias y niveles elevados y persistentes de citoquinas y quimiocinas como: IL-1beta, IL-2, IL-6, IL-7, IL-10, GM-CSF, IP-10, MCP-1 y TNF-alfa. Lo anterior promueve el desarrollo de inmunopatología severa denominada “tormenta de citoquinas” que a su vez desencadena múltiples consecuencias, como; edema pulmonar profuso, síndrome de dificultad respiratoria aguda (SDRA) y falla multiorgánica 14,15.
La detección de anticuerpos anti SARS-CoV-2, del tipo IgM puede observarse a partir del 4° día posterior a la infección y su concentración incrementa progresivamente hasta alcanzar un pico máximo alrededor del 20° día y decae posteriormente. La detección de anticuerpos tipo IgG ocurre desde el 7° día y alcanza su nivel más alto aproximadamente el día 25° manteniéndose niveles altos después de 4 semanas del inicio de la infección. Sin embargo, la producción de anticuerpos está estrechamente relacionada con el grado de severidad de la infección, y algunos trabajos han reportado que los individuos que presentaron formas más severas de la infección tuvieron una respuesta de IgG más robusta que los individuos con formas leves de la enfermedad e inclusive se han reportado casos de individuos analizados que fueron seronegativos para anticuerpos IgG, principalmente aquellos que fueron clínicamente asintomáticos. También se ha reportado que los anticuerpos neutralizantes detectados para SARS-CoV-2 empiezan a disminuir entre los 2 y 3 meses después de la infección 16.
Síntomas de la COVID-19
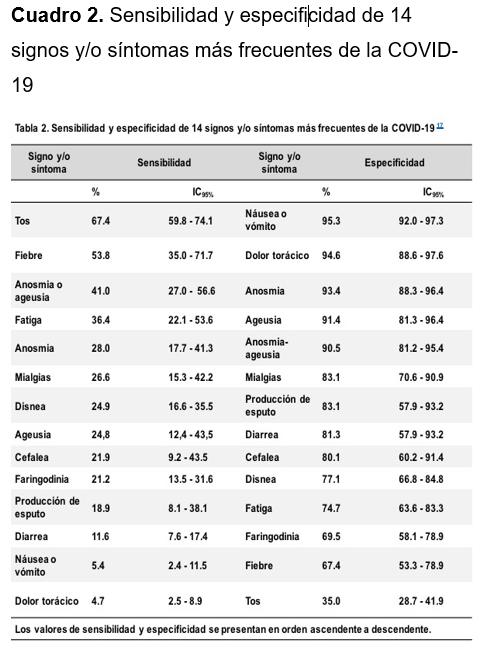
El espectro clínico de los pacientes con COVID-19, es amplio y variable. Algunos pacientes pueden permanecer asintomáticos o presentar síntomas leves, mientras que otros cursan con neumonía e incluso pueden llegar a la muerte. De acuerdo con un meta-análisis realizado en pacientes captados en atención primaria y servicios ambulatorios, a la fecha se describen hasta 84 signos y síntomas que pueden ser clasificados en seis categorías diferentes: síntomas del tracto respiratorio superior, del tracto respiratorio inferior, síntomas sistémicos, gastrointestinales, cardiovasculares y olfatorios. El análisis estadístico de los síntomas demostró que entre los 14 síntomas más frecuentes (Cuadro 2), la sensibilidad es baja, mientras que la especificidad es alta, por lo que la presencia o ausencia de ellos, no descarta o confirma la enfermedad 17.
Pruebas diagnósticas de SARS-CoV-2
Hasta el momento, la reacción en cadena de la polimerasa (PCR) es la prueba considerada como “estándar de oro”, la cual se fundamenta en la identificación del RNA viral mediante la acción de la transcriptasa inversa, y amplificación de ácidos nucleicos, que convierten al RNA viral en un cDNA (DNA complementario) 18. Las muestras deben ser recolectadas de la vía nasofaríngea u orofaríngea; en pacientes graves es aceptable recolectar muestras de vías respiratorias bajas, esputo y aspirado endotraqueal o lavado broncoalveolar 19. La PCR tiene su máxima sensibilidad en los primeros siete días desde el inicio de los síntomas, y a partir de la segunda semana la sensibilidad baja pues la carga viral disminuye. Se ha estimado que su sensibilidad es de 85% a 90% y cuenta con una especificidad del 100%. Es importante señalar que la metodología para la detección del SARS-CoV-2, se desarrolló previamente para la detección de los coronavirus SARS-CoV y el causante del síndrome respiratorio de Oriente Medio (MERS-CoV). Por último, se debe valorar que un resultado negativo no excluye la infección. Del mismo modo, un resultado positivo no implica que exista replicación viral o capacidad de infección, pues la prueba puede detectar fragmentos de material genético no funcional. Se recomienda considerar la utilidad de la detección viral teniendo en cuenta el contexto clínico 8,20.
Las pruebas de detección de antígenos específicos (Ag), consisten en la detección de proteínas virales del SARS-CoV-2, como la proteína N y las subunidades de la proteína S. Del mismo modo, las muestras utilizadas proceden de los exudados nasofaríngeos, orofaríngeos o de esputo, y el estudio debe realizarse en los primeros cinco a siete días del inicio de los síntomas, tiempo en el que se presenta la mayor tasa de replicación viral. Se considera que estas pruebas tienen una sensibilidad del 95% y la especificidad oscila entre 95% a 99%, representando una alternativa importante en la detección masiva de personas infectadas 21.
Los anticuerpos (Ac) IgM/A e IgG contra antígenos específicos del SARS-CoV-2, pueden ser detectados en muestras de sangre, plasma o suero mediante inmunoensayo enzimático (ELISA), por quimioluminiscencia (CLIA, ECLIA) o de flujo lateral (LFIA). Las pruebas que detectan los anticuerpos específicos de uno o varios isotipos, contra la proteína N o S del virus, son útiles en el seguimiento de la respuesta inmunológica de individuos que ya han sido infectados por este virus, pues permiten identificar a pacientes que cursaron con infección reciente sintomática, a partir de las semanas tres y cuatro 22. Es importante mencionar que hasta el momento no se conoce con certeza la duración de la presencia de anticuerpos. Este tipo de pruebas tienen una sensibilidad de más del 90% a partir de la 3ª semana de la infección, y una especificidad variable que puede ir del 90% al 99%. También existen pruebas rápidas para la detección de anticuerpos, aunque su sensibilidad y especificidad pueden ser menores 23. Debido al mayor riesgo de resultados falsos negativos, las pruebas de detección de antígenos y de detección de anticuerpos, se consideran como complemento de las pruebas de RT-PCR, específicamente en los casos que hayan transcurrido más de 10 días después de la aparición de los síntomas, en la evaluación de infecciones anteriores y/o en la definición de las respuestas humorales 21. Al mes de septiembre del 2021, se disponía ya de más de 240 pruebas diagnósticas para la COVID-19, con nivel de autorización de uso de emergencia. Es importante señalar que todas las pruebas novedosas necesitan definir valores de corte útiles en la práctica clínica 8,23,24.
Gravedad de la COVID-19
La OMS, con base en indicadores clínicos elaboró las definiciones de gravedad de la COVID-19, y han agrupado a este padecimiento en: 1) Enfermedad leve: Pacientes sintomáticos que se ajustan a la definición de caso de COVID-19 (fiebre, tos, cefalea o dificultad respiratoria), pero que no presentan neumonía vírica, ni hipoxia. 2) Enfermedad moderada: Adolescentes o adultos con signos clínicos de neumonía (fiebre, tos, disnea, taquipnea), pero sin signos de neumonía grave, en particular SpO2 ≥ 90% con aire ambiente. 3) Enfermedad grave: Adolescentes o adultos con signos clínicos de neumonía, más alguno de los siguientes: frecuencia respiratoria > 30 inspiraciones/min; disnea grave o SpO2 < 90% en aire ambiente. 4) Enfermedad crítica: Inició en la semana siguiente a una lesión clínica conocida (por ejemplo, neumonía), con aparición de nuevos síntomas respiratorios o empeoramiento de los existentes. En esta fase se pueden presentar complicaciones que pueden llevar a la muerte del paciente, por ejemplo: a) Síndrome de dificultad respiratoria aguda (SDRA) definido en adultos, por oxigenación deficiente, que puede ser leve: 200 mmHg < PaO2/FiO2 ≤ 300 mmHg (con PEEP o CPAP ≥ 5 cmH2O), SDRA moderado: 100 mmHg < PaO2/FiO2 ≤ 200 mmHg (con PEEP ≥ 5 cmH2O), y SDRA grave: PaO2/FiO2 ≤ 100 mmHg (con PEEP ≥ 5 cmH2O). b) Choque séptico, que provoca disfunción orgánica aguda y potencialmente mortal, causada por una desregulación de la respuesta inmune del huésped a la infección. Los signos de disfunción orgánica son: alteración del estado mental (delirio, confusión), disnea o taquipnea, SpO2 baja, oliguria, taquicardia, pulso débil, extremidades frías o hipotensión arterial, piel jaspeada, datos de coagulopatía en las pruebas de laboratorio, trombocitopenia, acidosis, hiperlactatemia o hiperbilirrubinemia, además, los niveles de Lactato sérico pueden ser > 2 mmol/l e hipotensión persistente que, pese a la reposición de la volemia, necesita vasopresores para mantener una TA media ≥ 65 mm Hg. c) Trombosis aguda: Tromboembolia pulmonar, síndrome coronario agudo, y accidente cerebrovascular agudo 25,26.
Factores pronósticos en la COVID-19
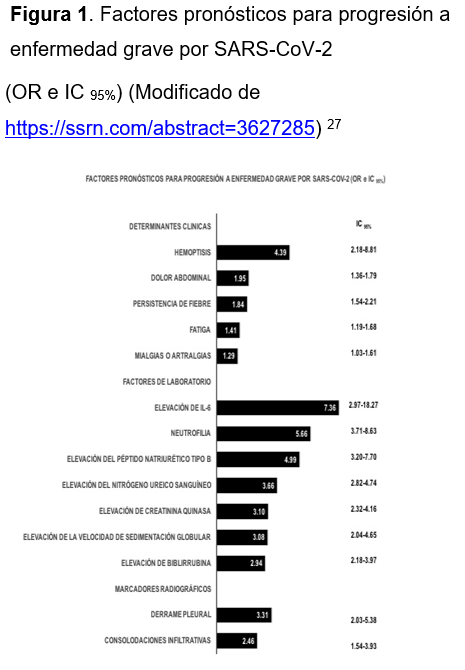
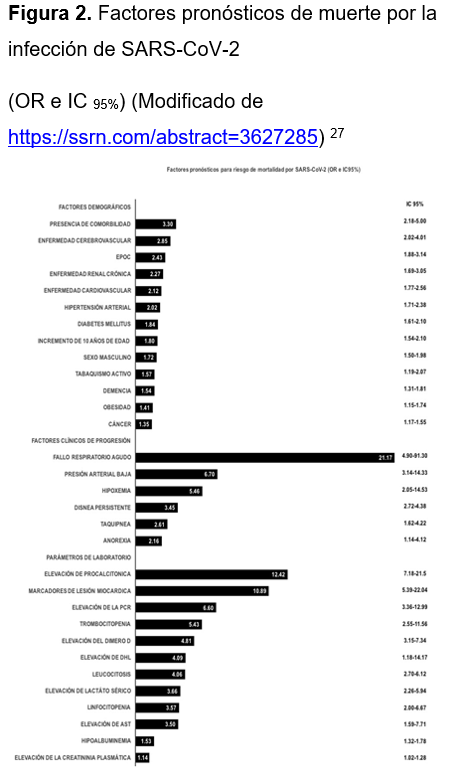
Se han descrito diversos factores de riesgo para la progresión de la enfermedad de leve a grave y de la enfermedad grave al riesgo de muerte. Los factores de riesgo para progresión a enfermedad grave, se resumen en la Figura 1 27. Mientras que los factores descritos para riesgo de mortalidad por el SARS-CoV-2, se resumen en la Figura 2 27,28.
Mucormicosis (hongo negro) y COVID-19
La mucormicosis es una infección oportunista ocasionada por hongos ambientales saprófitos que pertenecen al sub-phylum Mucormycotina, orden Mucorales. Es una infección potencialmente mortal que afecta a individuos que presentan inmunocompromiso, como en pacientes con diabetes mellitus, neoplasias hematológicas o con tratamiento inmunosupresor. La mucormicosis provoca la necrosis de los tejidos, principalmente de la mucosa nasal, senos paranasales y órbita, así como del sistema nervioso central, pulmón y tracto gastrointestinal, entre otros 29.
La co-infección mucormicosis y Covid-19, es favorecida por el ambiente hipóxico generado en pacientes con cuadros graves o críticos, los altos niveles séricos de ferritina y de glucosa, así como la baja actividad fagocítica de los leucocitos secundaria a la propia infección viral y a los esteroides usados en su tratamiento. Es importante mencionar que la mucormicosis también se presenta en pacientes recuperados de Covid-19 (44% de los pacientes reportados en una serie de India, durante un periodo de tres meses después de la recuperación) 30. Las presentaciones clínicas de la mucormicosis pueden ser: rino-orbital (la más frecuente 62%), rino-orbito-cerebral (23.5%), pulmonar, cutánea, gastrointestinal y diseminada. Los síntomas y signos iniciales son: pérdida de visión, dolor orbitario o facial, edema periocular o facial, ptosis y secreción nasal. En la evolución de la enfermedad pueden presentarse otros síntomas asociados al sitio de afectación como: la parálisis de pares craneales, hipoestesia regional, disminución o pérdida de la visión, entre otros. La diseminación de las hifas es por vía hematógena, lo que ocasiona en casos graves trombosis vascular, que de forma frecuente se presenta en el seno cavernoso. El diagnóstico se puede realizar por imagen, en cuyo caso el estudio de elección es mediante resonancia magnética (RM) con contraste. En los pacientes en los que no se pueda usar la RM, la tomografía computada con contraste o sin él (en pacientes en los que no se pueda emplear el medio de contraste) es el estudio a utilizar. El diagnóstico rápido puede realizarse con microscopía directa utilizando preparaciones húmedas de KOH. Es necesaria la realización de cultivo para la identificación del género, la especie y la susceptibilidad a los antifúngicos. El tratamiento en general es el desbridamiento quirúrgico y el uso de antimicóticos. La anfotericina B es el fármaco de elección, la forma liposomal de la anfotericina B, el posaconazol y el isovuconazol, son alternativas de tratamiento efectivas, en cuyo caso el costo es elevado 31.
Es importante mencionar, que aunque en nuestro país se han reportado casos aislados de mucormicosis asociada a la COVID-19, es necesario tener el conocimiento para su identificación y tratamiento oportuno 32.
Embarazo y COVID-19
Desde el principio de la pandemia, la controversia sobre la mayor susceptibilidad de las mujeres embarazadas a la infección por SARS-CoV-2 no ha concluido, es decir, ¿Sí los cambios inmunológicos que se producen en el embarazo, provocan que la mujer embarazada sea más vulnerable o no, a contraer SARS-CoV-2, y si la COVID-19 sería grave o crítica? 33. Inicialmente algunos autores argumentaron que el embarazo podría proteger contra la “tormenta de citoquinas” de la COVID-19, debido a que los bajos niveles de TNF-a (factor alfa de necrosis tumoral) disminuyen la actividad proinflamatoria Th1 (células T cooperadoras de tipo 1). En la actualidad varios trabajos han establecido que la población embarazada no es, en general, más vulnerable a contraer el SARS-CoV-2; sin embargo, el curso clínico de la enfermedad puede ser más grave durante el embarazo, y puede producirse un rápido deterioro, especialmente después de 28 semanas. El embarazo aumenta la probabilidad de que la mujer desarrolle una enfermedad grave, hospitalización, ingreso en la unidad de cuidados intensivos (UCI), y requerimiento de ventilación mecánica. Además, tener COVID-19 grave, aumenta las probabilidades de parto prematuro y por cesárea 34,35. También se ha visto que las mujeres embarazadas de países en desarrollo, tienen frecuentemente enfermedades subyacentes, como; diabetes, hipertensión y sobrepeso u obesidad, lo que incrementa el riesgo de complicaciones 34. Los síntomas más comunes son la fiebre y la tos, con tasas del 32,8% y el 41,3% respectivamente, en comparación con el 77% y el 68% en la población general. La duración media de los síntomas es de aproximadamente un mes, aunque una cuarta parte de las pacientes pueden tener algunos síntomas persistentes durante más de dos meses. Los porcentajes de personas con la infección asintomática son difíciles de calcular, no obstante los Centros para el Control y la Prevención de Enfermedades (CDC) dan una estimación del 40% en la población general, mientras que el rango calculado de infección asintomática en mujeres embarazadas va del 9% al 30,9%. Las mujeres embarazadas inicialmente asintomáticas, pueden presentar la COVID-19 grave y deteriorarse rápidamente 33,36.
Es menos probable que las mujeres embarazadas informen de los síntomas, por que semejan los cambios fisiológicos propios del embarazo, como; disnea, fatiga, mialgia, síntomas gastrointestinales, e incluso fiebre, lo que contribuye al retraso en el diagnóstico entre la población embarazada y la primera presentación en una forma grave de la COVID-19 37. Respecto a las complicaciones en las mujeres embarazadas, estas son semejantes a las que presentan las no embarazadas. La importancia de estas complicaciones es que pueden tener impacto negativo en el binomio madre-hijo. Por otro lado, la tasa de óbitos, en mujeres embarazadas con la COVID-19 se calcula en un 0,6% hasta un 3% 34. Actualmente, hay evidencia de que las mujeres que se infectan con SARS-CoV-2 durante el embarazo transfieren anticuerpos al recién nacido, ya que se han detectado anticuerpos tipo IgG específicas de SARS-CoV-2, aunque no existe evidencia consistente de que haya transmisión vertical de la enfermedad (vía placentaria). La lactancia es recomendada pues se han encontrado anticuerpos polifuncionales de tipo IgA específicos contra SARS-CoV-2 en la leche materna 33,35,38.
Población pediátrica y COVID-19
La población pediátrica, incluyendo neonatos, también es susceptible a la infección por el SARS-CoV-2, aunque se piensa que su frecuencia es menor que en el adulto. Se sabe que hasta el 90% de los pacientes pediátricos cursan con una enfermedad asintomática, y sólo el 1% evolucionará a una enfermedad severa o crítica, en cuyo caso está asociado a la presencia de comorbilidades 37,39. La fuente de contagio de forma principal es en el domicilio y del mismo modo que en el paciente adulto, la presentación clínica es variable. En la población pediátrica, la enfermedad se ha clasificado en: 1) Enfermedad leve: pacientes sintomáticos que cumplen con la definición de caso para COVID-19 sin evidencia de neumonía viral hipoxia o sepsis. 2) Enfermedad moderada: datos clínicos de neumonía no severa. 3) Enfermedad severa: datos clínicos de neumonía (tos, dificultad para respirar), más uno de los siguientes: cianosis central, saturación de oxígeno menor de 90%, dificultad respiratoria, quejido, uso de músculos accesorios, taquipnea, apneas intermitentes. Se han descrito algunos datos de alarma: intolerancia a la vía oral, deshidratación, alteración en el estado de conciencia, somnolencia, letargo,y crisis convulsivas. 4) Enfermedad crítica: se clasifican en este apartado aquellos pacientes pediátricos que requieren ingresar a unidades de cuidados intensivos por: insuficiencia respiratoria que requiere ventilación mecánica, síndrome de dificultad respiratoria aguda, síndrome de respuesta inflamatoria sistémica e insuficiencia orgánica múltiple 25.
El síndrome inflamatorio multisistémico pediátrico asociado a Covid 19, lo presentan aquéllos que cursan con una enfermedad crítica, y comparte características parecidas a otros procesos inflamatorios pediátricos, como: enfermedad de Kawasaki, síndrome de choque tóxico (estreptococo y estafilococo), sepsis bacteriana y síndrome de activación de macrófagos. Éste cuadro denominado síndrome inflamatorio multisistémico pediátrico, suele manifestarse con un cuadro de dolor abdominal intenso, fiebre persistente, elevada y de difícil control, además de concentraciones altas de marcadores de inflamación 40.
Los criterios de la OMS para el diagnóstico del síndrome inflamatorio multisistémico pediátrico son: niños y adolescentes menores de 19 años con fiebre de más de tres días de duración, más dos de los siguientes síntomas; exantema, conjuntivitis bilateral, alteraciones mucocutáneas (oral, pies y manos), hipotensión o choque, alteraciones gastrointestinales (diarrea, vómito o dolor); datos de disfunción miocárdica, pericarditis, valvulitis, alteraciones coronarias o elevación de troponina, péptido natriurético cerebral, evidencia de coagulopatía (trombocitopenia, dímero D elevado), elevación de reactantes de fase aguda (proteína C reactiva, VSG y procalcitonina), sin otra causa infecciosa que lo explique 38.
Secuelas de la COVID-19
A la fecha no existe consenso para determinar a partir de cuanto tiempo posterior al periodo agudo de la enfermedad se considera una secuela por la enfermedad. Diversos estudios han demostrado que el 80% (IC95% 65 - 92) de los pacientes que cursaron con COVID-19, en un periodo de 14 a 110 días posteriores a la infección, presentan síntomas a largo plazo, y las manifestaciones clínicas más comunes son: fatiga 58% (IC95% 42 - 73), cefalea 44% (IC95% 13 - 78), trastornos de atención 27%( IC95% 19 - 36), pérdida de cabello 25% (IC95% 17 - 34) y disnea 24% (IC95% 14 - 36). Se han descrito hasta 55 manifestaciones clínicas a largo plazo. Otros incluyen síntomas pulmonares (tos, dolor torácico, apnea del sueño y fibrosis pulmonar), cardiovasculares (arritmias, miocarditis), neurológicas (demencia, depresión, ansiedad, trastorno de atención, trastornos obsesivo-compulsivos) y otros inespecíficos como acúfenos y sudoración nocturna 41,42. Respecto a la fatiga, que es la secuela más frecuente, los pacientes que se recuperan de la COVID-19, han reportado que pueden sentir dicha fatiga hasta por 100 días, y puede ser desde el inicio de la enfermedad. Mientras que en aquéllos pacientes que cursaron con síndrome de distrés respiratorio por COVID-19, la fatiga puede ser manifestada hasta un año después de la recuperación del cuadro agudo. Dentro de los hallazgos por estudios de gabinete, la persistencia de anormalidades en la radiografía de tórax o tomografía computarizada ocurre en 34% (IC95% 27 - 42), mientras que en los estudios de laboratorio, persiste la elevación del dímero D en 20% (IC95% 6 - 39), elevación del propéptido natriurético cerebral N-terminal 11% (IC95% 6 - 17), proteína C reactiva 8% (IC95% 5 - 12) y ferritina sérica 8% (IC95% 4 - 14) 41,42. Es importante mencionar que, aquellos pacientes que cursaron con cuadros graves o críticos de la COVID, pueden presentar, lo que se ha nombrado de forma reciente, síndrome post-sepsis y síndrome post-UCI, con un deterioro importante en la calidad de vida y un riesgo asociado mayor de muerte. Estos síndromes corresponden a una compensación inmunológica del estado hiper-inflamatorio agudo ocasionado por la infección del SARS CoV-2, que se caracterizan por una disminución de la respuesta inflamatoria sistémica, ocasionando inclusive una inmunosupresión, en consecuencia estos pacientes son propensos a infecciones bacterianas, fúngicas y virales. Además, los pacientes recuperados de SDRA, tienen un mayor riesgo de presentar fibrosis, por el aumento en la activación del factor de crecimiento transformante beta (TGF-B), citoquina con efecto pro-fibrótico, y la proliferación de fibroblastos en el tejido intersticial de los órganos afectados (pulmón, corazón, cerebro, entre otros). Sin embargo, aún se requieren más estudios al respecto para determinar la duración, tiempo de recuperación y el impacto a largo plazo, en la salud de los pacientes que presentan estas manifestaciones 43.
Tratamiento farmacológico de la COVID-19 en México
Al día de hoy, aún no hay tratamiento farmacológico específico contra el SARS-CoV-2. En diversas investigaciones clínicas, durante el período de emergencia por el brote de COVID-19 se probaron un sin número de tratamientos, con base principalmente en características patológicas y las distintas fases clínicas de la COVID-19. Los fármacos empleados incluyeron: antivirales, retrovirales, inhibidores de la inflamación, fármacos antirreumáticos, heparinas de bajo peso molecular, plasma e inmunoglobulinas hiperinmunes 44.
Recientemente las autoridades sanitarias de las diversas instituciones de salud pública de nuestro país, elaboraron y publicaron la “Guía clínica para el tratamiento de la COVID-19 en México”, en la que se indica la aplicación de tratamiento sintomático para la forma leve de la enfermedad y el uso de medicamentos para las formas moderadas y graves de la COVID-19, como: heparina no fraccionada/enoxaparina, dexametasona u otros corticosteroides, remdesivir y tocilizumab. Cabe señalar que estos son los fármacos que se prescriben en las unidades médicas del Instituto Mexicano del Seguro Social. En la misma guía se especifican los medicamentos que no deben usarse, como: azitromicina, dióxido de cloro, ciclosporina, factor de transferencia, hidroxicloroquina, lopinavir/ritonavir y oseltamivir, porque no han mostrado ningún beneficio en el combate contra la COVID-19. Finalmente se enlistan los medicamentos que sólo pueden emplearse para estudios de investigación 45.
Vacunas contra SARS-CoV-2
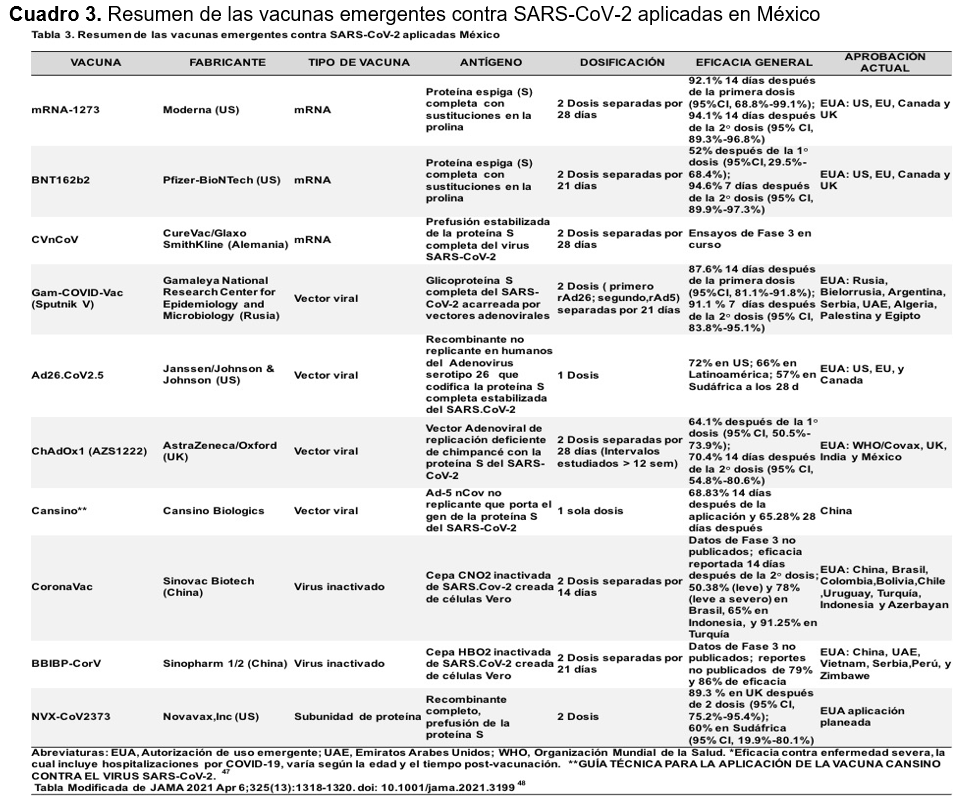
El desarrollo de la inmunidad artificial es quizá la estrategia de control a la que la mayor parte de la población mundial apostó para el control de la COVID-19. Es por ello que, desde el comienzo de la pandemia, los gobiernos de algunos de los países principalmente del primer mundo, iniciaron una carrera sin precedentes en el desarrollo de una vacuna que pudiera ser aplicada de forma masiva. Vale la pena señalar que un cuestionamiento persistente, acerca de la protección conferida por las diferentes vacunas es; si son capaces de proteger contra todas las variantes de preocupación, principalmente contra la variante delta, la cual se ha descrito que es 60% más contagiosa que las precedentes. La mayoría de las compañías que elaboran las vacunas, afirman que una vez que se ha cubierto su esquema de aplicación, protegen contra todas las variantes. Las vacunas aplicadas son altamente efectivas para prevenir enfermedades graves y muertes, pero no son 100% eficaces para evitar la infección o reinfección, no obstante, tienen un importante nivel de protección contra la forma grave de la enfermedad y contra un desenlace fatal. Actualmente se evalúa la posibilidad de una tercera dosis en ciertas vacunas 46. La Cuadro 3 resume la información sobre las vacunas disponibles en la actualidad y que se aplican en México 47,48.
Conclusiones y perspectivas
La pandemia provocada por el SARS-CoV-2, ha afectado al ser humano en todos sus ámbitos; salud, político, sociocultural, económico, científico, entre otros. Además, ha ocurrido una interacción científica sin precedentes a nivel mundial, destacando la prolífica publicación de información científica y el desarrollo de vacunas contra el SARS-CoV-2. Por otro lado, los profesionales de la salud nunca se habían enfrentado a un desafío semejante. Sin embargo, desarrollaron en circunstancias adversas, la habilidad para incorporar estrategias, intervenciones y algoritmos conforme cambia la evidencia científica generada sobre este padecimiento.
En todo el mundo, la pandemia por SARS-CoV-2, provocó la reorganización de los sistemas de salud en todos los niveles de atención hospitalaria. Sin embargo, en los países como México, se evidenciaron los enormes rezagos e inequidades que presenta nuestro sistema de salud, como en; infraestructura, equipo médico, recursos humanos, entre otros. Además, se evidenció la elevada prevalencia de comorbilidades, como; hipertensión, obesidad, diabetes y enfermedades cardiovasculares, así como su impacto en muchos de los desenlaces fatales de nuestra población. Este panorama debería de llevar a los tomadores de decisiones a evaluar el costo beneficio de acciones dirigidas a la promoción de la salud y prevención de padecimientos crónico degenerativos de manera inmediata.
Por otro lado, las vacunas han dado la falsa idea de un control de la pandemia y de la posibilidad de lograr la inmunidad de rebaño. Nada más alejado de la realidad, pues no evitan que las personas no contraigan la infección por el SARS-CoV-2, pero sí disminuyen la probabilidad de presentar cuadros severos y desenlaces fatales. Tampoco debemos olvidar que el padecimiento es dinámico y su comportamiento podría cambiar en cualquier momento. Por otro lado, los tratamientos farmacológicos específicos y/o efectivos contra la Covid-19, son absolutamente necesarios y la investigación en este campo seguramente pronto tendrá opciones eficaces para tratar esta enfermedad.
La pandemia también ha traído beneficios, por ejemplo; las telecomunicaciones ofrecieron la oportunidad de atender a pacientes a distancia con lo que se evitó el desbordamiento de los servicios de salud. También se han desarrollado áreas tecnológicas, principalmente en los países del primer mundo, como es la robótica, con la creación de robots capaces de detectar sintomatología asociada a la COVID-19, entre otras funciones. Los beneficios de estas tecnologías, se espera sean aplicados en el resto del mundo. Es posible que una de las principales enseñanzas que nos está dejando esta pandemia, es que debemos concientizarnos que esta zoonosis nos llevará, además de promover la salud de la humanidad, a buscar un equilibrio con la naturaleza. Finalmente, esperamos que la información de este manuscrito sea útil en su práctica clínica.
Conflicto de intereses: Los autores declaran que no existen conflictos de intereses
Agradecimientos: A todo el personal médico, paramédico y administrativo de la UMF-28, UMAE de Especialidades y de Oncología, Centro Médico Nacional Siglo XXI.
REFERENCIAS