Rev Med UAS
Vol. 12: No. 3. Julio-Septiembre 2022
ISSN 2007-8013
Rosa Adriana Jarillo-Luna1, Juan Manuel Gutiérrez-Meza1, Elizabeth Barbosa-Cabrera1, Gabriela Rebeca Luna-Palencia2, Martha Cecilia Rosales-Hernández3, Mario Nequiz4, Judith Pacheco-Yepez1,*
* Correspondencia: Judith Pacheco-Yépez
Sección de Estudios de Posgrado e Investigación, Escuela Superior de Medicina, Instituto Politécnico Nacional
Plan de San Luis y Salvador Díaz Mirón s/n, Col. Santo Tomas, Ciudad de México. México 11340.
Telefono: 52 55 35183193 e-mail: jpachecoy@ipn.mx
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v12.n3.005
Texto Completo PDFRecibido 09 de mayo 2022, aceptado 16 de junio 2022
RESUMEN
Objetivo: Realizar un análisis comparativo in vitro de la actividad anti-amibiana del flavonoide Camperol comparado con la droga de referencia, el Metronidazol y determinar si el mecanismo de daño es oxidativo. --- Metodología: Se aplicaron diferentes concentraciones de Camperol y Metronidazol a trofozoítos de Entamoeba histolytica, analizando mediante microscopia electrónica el daño estructural ocasionado, por métodos colorimétricos el efecto antiamibiano en y sin condiciones de oxigenación, daño al DNA por método fluorométrico, la citotoxicidad de los fármacos en células HeLa por métodos colorimétrico y la producción de anión superóxido mediante resonancia paramagnética electrónica. Resultados: El grado de destrucción amibiana depende del tiempo y concentración del flavonoide. Camperol mostro una actividad antiambiana contra Entamoeba histolytica similar a la del Metronidazol; indujo cambios ultraestructurales en el citoplasma de los trofozoítos de Entamoeba histolytica, y alteración de la membrana celular, indujo daño al DNA, mostro un efecto prooxidante y mantuvo su actividad anti-amibiana en un medio altamente oxigenado. Finalmente, el Camperol no mostro toxicidad contra células HeLa. --- Conclusiones: Los efectos antiamibianos se deben a las características prooxidantes del Camperol, efecto que supera los mecanismos anti-oxidantes de la amiba, sugiriendo que in vivo sería un mejor amebicida que el Metronidazol.
Palabras clave: Entamoeba histolytica, Camperol, anti-amibiana prooxidante, cambios ultraestructurales
Abstract
Objective: Perform a comparative in vitro analysis of the anti-amoebic activity of the flavonoid Camperol compared to the reference drug, Metronidazole and determine if the damage mechanism is oxidative. --- Methodology: Different concentrations of Camperol and Metronidazole were applied to Entamoeba histolytica trophozoites, analyzing by electron microscopy the structural damage caused, by colorimetric methods the anti- amoebic effect with and without oxygenation conditions, the DNA damage by fluorometric method, the cytotoxicity of Camperol in HeLa cells by colorimetric method and the production of superoxide anion by electron paramagnetic resonance. --- Results: The degree of amoebic destruction depends on the time and concentration of the flavonoid. Camperol showed anti-amoebic activity against Entamoeba histolytica similar to Metronidazole; induced ultrastructural changes in the cytoplasm of Entamoeba histolytica trophozoites, and alteration of the cell membrane, induced DNA damage, showed a prooxidant effect and maintained its anti-amoebic activity in a highly oxygenated medium. Finally, Camperol did not show toxicity against HeLa cells. --- Conclusions: The anti-amoebic effects are due to the pro-oxidant characteristics of Camperol, an effect that exceeds the anti-oxidant mechanisms of the amoeba, suggesting that in vivo it would be a better amebicide than Metronidazole.
Keywords: Entamoeba histolytica, kaempferol, prooxidant anti-amoebic, ultrastructural changes,
INTRODUCCIÓN
Entamoeba histolytica (E. histolytica) es el agente etiológico de la amibiasis, una enfermedad en humanos caracterizada por trastornos como disentería y absceso hepático amibiano1. El tratamiento eficaz contra E. histolytica es el Metronidazol. Sin embargo, el tratamiento durante largos periodos es acompañado por efectos indeseables como nausea, vómito y diarrea 1, 2, 3. Además, se ha mostrado que está droga presenta actividad mutagénica 4, 5 y efectos cancerígenos en roedores 6, así como efectos tóxicos cuando es utilizada a dosis elevadas 7, 8 . Estudios in vitro han reportado que algunas cepas de amiba son resistentes a este tratamiento 9, 10. Debido a ello, existe la necesidad de investigar nuevos tratamientos que sean efectivos en la eliminación de la amiba.
Los flavonoides son un grupo de compuestos que presentan varias propiedades farmacológicas11, incluidas actividades antibacterianas, antifúngicas y antivirales 12. Los flavonoides presentan efectos anti oxidante y anti inflamatorio 11, 13. Aunque el papel antioxidante de los flavonoides has sido ampliamente documentado, existen muchos estudios que reportan su actividad prooxidante, la cual parece depender de su concentración y es directamente proporcional al número total de grupos OH en la molécula, especialmente aquellas localizadas en el anillo B 14.
Por otra parte, se ha reportado que extractos, fracciones y flavonoides purificados de plantas presentan un efecto in vitro contra E. histolytica. La actividad anti-amibiana de los flavonoides se ha medido como porcentaje de inhibición de crecimiento utilizando un método de subcultivo 15-22. Trabajos recientes han demostrado que el Camperol daña a los trofozoítos de E. histolytica, afecta principalmente a las proteínas del citoesqueleto lo que ocasiona alteración de los mecanismos de virulencia23. No obstante el conocimiento adquirido, sus blancos y mecanismos de acción no son completamente conocidos. El objetivo del presente estudio fue realizar un análisis comparativo de la actividad anti-amibiana del Camperol a diferentes tiempos de interacción, analizar el efecto prooxidante del flavonoide y determinar los cambios ultraestructurales inducidos por el Camperol, comparando estos cambios con el fármaco de referencia, el Metronidazol.
Material and Métodos
Cultivo amibiano
Trofozoítos de E. histolytica de la cepa HM-1: IMSS fueron cultivados axénicamente en medio de cultivo Diamond (TYI-S-33) a 37°C complementado con suero bovino al 20% (GIBCO BRL, USA)24. Los trofozoítos fueron colectados a las 48 h.
Fármacos
Se utilizó el flavonoide Camperol (Sigma Aldrich Chemical Company, St. Louis, Mo. USA) y se diluyo en dimetil sulfoxido (DMSO) (Sigma)/ amortiguador de fosfatos (PBS) para preparar las diferentes soluciones de trabajo (0.7, 1.4 and 2.1 mM). El Metronidazol fue utilizado a las mismas concentraciones (Flagyl, Sanofi-Aventis, México). La concentración final de DMSO en el medio de cultivo nunca supero 0.01% (v/v). Las muestras incubadas con 0.01 (v/v) de DMSO se usaron como control.
Efecto anti-amibiano
Se utilizaron dos métodos para cuantificar la viabilidad amibiana: tinciones con cristal violeta y azul tripano. En ambos métodos, 1 x 105 / 0.1 ml de trofozoítos se incubaron independientemente con 0.7, 1.4 y 2.1 mM de cada fármaco durante 2, 3 y 4 h a 37oC. El ensayo de cristal violeta se realizó en placas de 96 pozos (Costar, New York, NY, USA). Luego de la interacción con los fármacos, las placas se lavaron con PBS y las amibas adheridas se fijaron colocado en cada pozo 100 µl de metanol al 99% durante 2 min a temperatura ambiente (TA). Posteriormente los trofozoítos se tiñeron con 100 µL de solución de cristal violeta al 1% (Difco, Kansas City, KS, USA) por 10 min a TA, se descartó el colorante y se lavó. El colorante unido a las amibas en cada pozo se solubilizó con 100 µL de SDS 1% en etanol al 50%. La densidad óptica se determinó a 570 ⁄ 620 nm en lector de microplaca (Bio-Rad, Laboratories, CA, USA) y el porcentaje de trofozoítos viables se calculó por extrapolación a partir de la curva estándar.
Para el ensayo con azul tripano, los trofozoítos se colocaron en microtubos e interaccionaron con cada fármaco a las condiciones antes mencionadas. Luego, se mezclaron10 μl de la suspensión de parásitos con el mismo volumen de azul tripano (0.5 mg/ml) (Sigma-Aldrich, USA), la mezcla se incubó durante 2 min a TA. Las amibas teñidas (no viables) y no teñidas (viables) se contaron en hemocitómetro obteniendo los respectivos porcentajes de células. Se examinaron cien trofozoítos en cada momento. Como grupo control se consideró a amibas sin ningún tratamiento.
Ensayo de citotoxicidad in vivo
Se sembraron células HeLa at 1x103/ 0.1 ml en medio Dulbecco modificado (DMEM) (Gibco) suplementado con suero fetal bovino descomplementado en placas de cultivo 96 pozos en una atmósfera humificada de 5% CO2 a 37oC, durante 24 h. Las células se interaccionaron durante 2, 3 y 4 h con Camperol o Metronidazol en las concentraciones mencionadas previamente. Posteriormente, se agregó solución de azul tripano al 0.4% (Sigma) 1:1 (v/v) y se determinó el porcentaje de viabilidad utilizando el contador de células automatizado TC10 (Bio-Rad), mediante la siguiente formula: % células viables = (célula viva/células totales) x 100.
Cambios ultrastructurales
Para determinar los cambios ultrastructurales inducidos por los fármacos, se incubaron 1 X 106 amibas en presencia de Camperol y Metronidazol a las concentraciones antes mencionadas durante 2, 3 y 4 h a 37°C. Las amibas se fijaron con glutaraldehído al 2% (Electron Microscopy Sciences (EMS), Hatfield, PA, USA) diluido en solución de cacodilato sodio 100 mM (EMS) durante 60 min, posteriormente se fijaron con tetróxido de osmio al 2% (EMS) en el mismo amortiguador durante 60 min. Se eliminó el tetróxido de osmio y las muestras se deshidrataron con concentraciones crecientes de etanol antes de tratarlas con óxido de propileno (EMS). Los parásitos se incluyeron en resina epoxi (EMS) y se polimerizaron a 60°C por 24 h. Cortes ultrafinos fueron teñidos con acetato de uranilo (EMS) seguido de citrato de plomo (EMS)25. Las muestras se examinaron en un microscopio electrónico de transmisión Philips EM 208 S (Royal Philips Electronics, Amsterdam, Netherlands).
Cuantificación del daño al DNA
El porcentaje de daño al DNA se determinó con una versión modificada de un método previamente reportado26. Brevemente, se sembraron 2 x105 trofozoítos en placas de cultivo de 96 pozos e incubaron en presencia de cada fármaco a las concentraciones mencionadas durante 2, 3 y 4 h at 37°C. Al cabo del tiempo de incubación, se retiró el medio de cultivo de los pozos y las placas se congelaron a -80°C y se descongelaron a 37°C. El reactivo SYBR Green I (Sigma) se diluyó 1:5000 en amortiguador de lisis (0.08%(v/v) con Triton X-100 (Sigma), 200 mM TRIS (Sigma), 5 mM EDTA (Sigma), pH 8.0 y 100 µl de esta solución se agregó a cada pozo. Las placas se incubaron en la oscuridad durante 30 min a TA con agitación suave constante. La fluorescencia se midió en un espectrofotómetro de microplacas Eon (Winooski, United State) a una longitud de ondas de excitación de 485 y de emisión 535 nm. El porcentaje medio de daño al DNA de los trofozoítos se calculó como [1-(fluorescencia media de los pozos con trofozoítos y fármaco/fluorescencia media de pozos con trofozoítos y sin fármaco)] x 100 y se graficó en función del tiempo de incubación.
Cuantificación de anión superóxido
Para explorar si el Camperol presentaba un efecto prooxidante sobre E. histolytica, se cuantifico la producción anión superóxido (•O2-) mediante resonancia paramagnética electrónica (EPR). Se colocaron 2.5 x 105 amibas en 0.5 ml de medio TYI-S-33 en microtubos de 1ml y se interaccionaron con las concentraciones mencionadas de cada fármaco durante 2, 3 y 4 h a 37°C. Al final del tiempo de interacción, las amibas se trataron con el recolector de radicales CM-H (1 hidroxi-3-metoxicarbonil-2,2, 5,5-tetrametilpirrolidina), amortiguador Krebs (99 mM NaCl, 4.69 mM KCl, 2.5 mM CaCl2 x 2(H2O), 1.2 mM MgSO4 x 7 H2O, 2.5 mM NaHCO3, 1.03 mM KH2PO4, D Glucosa 5.6 mM, Na-HEPES 20mM), trihidrato de dietilditiocarbamato de sodio (DETEC; 5μM, Sigma) y sal de metasulfonato de deferoxamina (DF 25μM, Sigma) se disolvió en la mezcla de reacción que contenía CMH (10 mM), 89:3:8 % v/v de amortiguador Krebs :DETEC:DF. Después, a cada muestra se le añadió el CM-H para llegar a una concentración 0.5 mM. El CM-H y las muestras fueron procesadas dentro una cámara sellada con atmosfera de nitrógeno. Las muestras con CM-H se incubaron a 37°C durante 30 min en agitación constante. Las muestras se centrifugaron a 3000 rpm durante 15 min. El sobrenadante se colocó en capilares de 50 µL (Corning) dentro de la cámara nitrógeno y cada uno de los capilares fue sellado por ambos lados para posteriormente obtener las mediciones por EPR. El control positivo fue trofozoítos incubados con peróxido de hidrógeno (H2O2) a 1 mM. Las mediciones de la producción de •O2- se realizaron en un espectrómetro Bruker e-scan con los siguientes parámetros registrados: campo magnético 3490 G, ventana: 60 G, amplitud: 1.5 G, ganancia: 56.4, poder: 0.0155mW; frecuencia: 9.743 GHz y se utilizó el software adquisición WinEPR.
Actividad anti-amibiana bajo condiciones oxigenadas
Para explorar si el efecto anti-amibiano del Camperol se conservaba en condiciones de oxigenación, se empleó un método previamente reportado27. Brevemente, 1.0 x 106 trofozoítos fueron sembrados en placas de 96 pozos (Corning) y se incubaron con cada uno de los fármacos a las concentraciones previamente mencionadas durante 2, 3 y 4 h a 37oC en una incubadora modular (Billups-Rothenberg, CA, USA) purgada con 100% O2 durante 10 min. Después del tiempo de interacción, se determinó la viabilidad de los parásitos por refringencia positiva en presencia de azul tripano. Las amibas sin fármaco se consideraron como control.
Análisis estadístico
Los datos se expresan como la media ± SD de 3 ensayos independientes. La comparación entre 2 grupos fue analizada usando la prueba t de Student para datos no pareados. Para comparación entre más de dos grupos, se empleó ANOVA una vía. Si se identificaba un efecto principal o una asociación significativa (P ≤ 0.05), las medias de los grupos se compararon mediante la prueba de Bonferroni. Todos los análisis fueron realizados con Graph Pad Prism software (versión 6).
Resultados
El efecto anti-amibiano del Camperol es comparable con diferentes métodos experimentales
El Camperol mostro la máxima actividad anti-amibiana a la concentración 2.1 mM y 4 h de incubación. Como se muestra en el Cuadro 1, Camperol y Metronidazol mostraron actividad anti-amibiana similar sin diferencias significativas entre ellos tanto por el método de azul tripano (60.0 ± 4.08; 56.0 ± 4.09) como de cristal violeta (19.67 ± 2.49; 20.33 ± 3.68).
Camperol no es tóxico para las células HeLa
La toxicidad del fármaco fue evaluada en células HeLa interaccionadas con Camperol y cuantificadas mediante el método de azul tripano. Como se muestra en el Cuadro 2, la viabilidad de las células HeLa no se modificó en comparación con los controles (P ≥ 0.05). Estos datos mostraron que el Camperol no es tóxico para la línea celular HeLa.
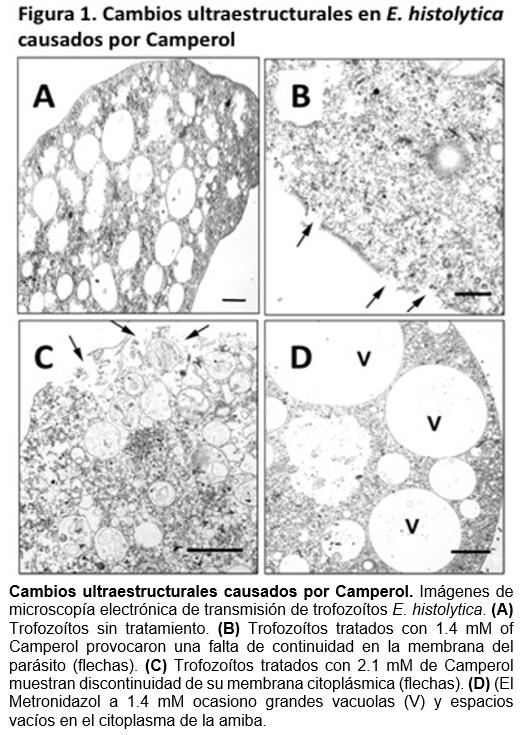
Camperol induce cambios ultraestructurales en E. histolytica
Los trofozoítos sin tratamiento mostraron una morfología y distribución de vacuolas normales, así como integridad en su membrana (Figura 1 fotografía A). Camperol a 1.4 mM y 4 h de interacción indujo perdida de continuidad en algunas áreas de la membrana citoplasmática de la amiba (Figura. 1 fotografía B). El Camperol a 2.1 mM y 4 h de interacción indujo la presencia de vacuolas en el citoplasma y la ruptura completa de la membrana así como salida del contenido citoplasmático (Figura. 1 fotografía C). El Metronidazol provoco incremento en el tamaño de las estructuras vesiculares y grandes espacios vacíos en el citoplasma (Figura. 1 fotografía D) seguido de lisis celular.
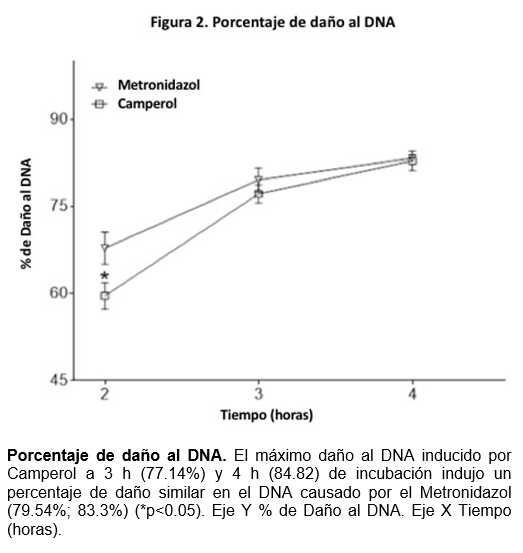
Camperol indujo daño en el DNA similar al del Metronidazol
En comparación con el Metronidazol, el Camperol indujo un porcentaje de daño al DNA similar al ocasionado por el Metronidazol (82.8 %) (P ≥ 0.05) (Figura 2).

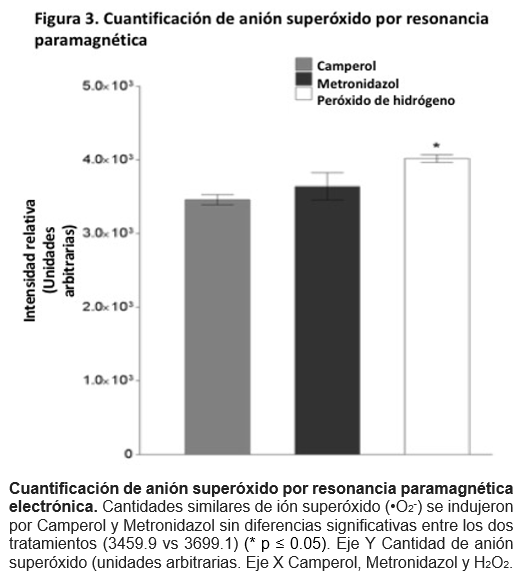
Camperol indujo una producción de •O2- similar al Metronidazol
No se observaron diferencias significativas entre los trofozoítos tratados con Camperol o Metronidazol, estos fármacos mostraron una elevada concentración de •O2- (3459.9 ± 69.1 and 3699.0 ± 183.6 respectivamente) (P ≥ 0.05). Como se muestra en la Figura 3, el control positivo (tratado con H2O2) mostró la más alta concentración de •O2- (4015.52.4 ± 52.4) (P ≤ 0.05).
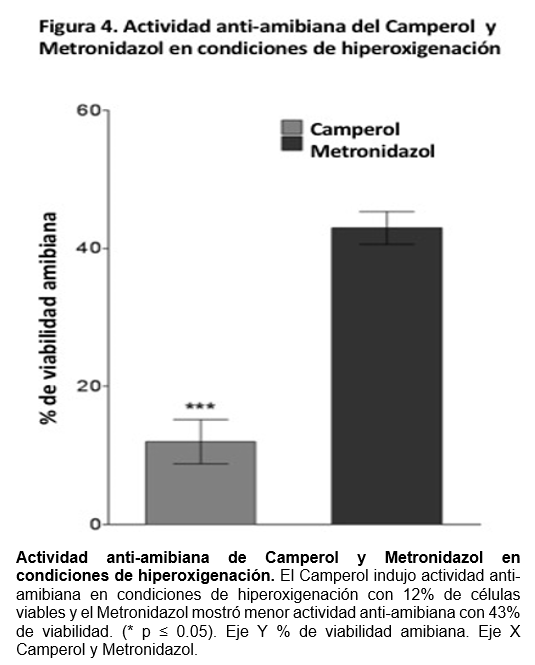
Camperol mantiene su actividad anti-amibiana en condiciones oxigenadas
En condiciones oxigenadas, el efecto anti-amibiano del Metronidazol no mostró diferencias significativas entre los grupos (43.3% ± 6.1) (P ≥ 0.5). Sin embargo, la actividad anti-amibiana del Camperol se incrementó significativamente en presencia de oxígeno (12.0% ± 2.4) (P ≤ 0.5) (Figura 4).
Discusión
Nuestros resultados muestran que el Camperol, presenta una actividad anti-amibiana a concentración de 2.1 mM, y este efecto fue similar al observado para Metronidazol. Nuestros resultados difieren de reportes previos donde se menciona que el Camperol purificado de plantas fue menos activo que el Metronidazol16.
El efecto anti-amibiano del Camperol fue evaluado mediante diferentes ensayos de viabilidad celular y mostro el mismo efecto citotóxico. Para excluir que la concentración de Camperol y Metronidazol utilizada pudiera dañar a células humanas se probaron las mismas concentraciones en células HeLa, y no se observó daño.
El análisis ultraestructural mostro cambios en E. histolytica después de 4 h de incubación con el flavonoide, hubo daño en la membrana citoplasmática, núcleo y DNA. El Camperol indujo ruptura de la membrana plasmática y finalmente lisis de la amiba, hasta donde sabemos, no existen reportes previos que muestren daño a la membrana citoplasmática y lisis inducida por el Camperol.
Basados en reportes previos de inhibición de la síntesis y degradación de DNA inducida por Metronidazol28,29, nosotros determinamos si este efecto es producido por el flavonoide probado. Camperol indujo daño al DNA similar al ocasionado por Metronidazol. Estudios han reportado que el Camperol induce desestabilización del DNA al inhibir la unión de las topoisomerasas30.
Además de los efectos antioxidantes de los flavonoides, muchos estudios han reportado su actividad pro-oxidante. Los flavonoides con un anillo fenol como el Camperol (3, 4’,5, 7-tetrahidroxiflavona) son más prooxidantes que aquellos que presentan un anillo catecol tipo –epicatequina31. Se analizó el efecto prooxidante como un mecanismo de daño celular, para lo cual la producción de radicales •O2- se determinó por EPR en E. histolytica después de 4 h de incubación con Camperol. La concentración de •O2- en muestras de amibas incubadas con Camperol fue similar a la producida por el Metronidazol, esto probablemente se debe a la presencia del grupo fenol en el Camperol31. Nuestros resultados difieren de los reportados por Velázquez-Domínguez y cols, quienes encontraron que el Camperol induce una baja producción de especies reactivas de oxígeno (ROS). Sin embargo, consideramos que el Camperol presenta un efecto prooxidante que puede dañar a la amiba32.
Uno de los mecanismos propuestos para esté efecto prooxidante, es que los compuestos de polifenoles y sus complejos Fe2+ reaccionan con el •O2- para formar H2O2 y un radical semiquinona, lo que resulta en un comportamiento similar al de la superóxido dismutasa (SOD). La reactividad similar a la SOD, cataliza la dismutación de dos aniones •O2- a pH fisiológico en H2O2 and O2. Dado que estas reacciones forman H2O2, los compuestos polifenólicos pueden contribuir al estrés celular oxidativo33.
Además, se sabe que el oxígeno es tóxico para E. histolytica debido a su transformación en ROS, que interactúan con todas las biomoléculas presentes en la célula siendo altamente dañino para el parásito.
Debido a que la incubación de los trofozoítos con Camperol genera •O2-, suponemos que a pesar de los mecanismos de defensa amibianos contra la oxidación, la actividad prooxidante de los flavonoides superó estas defensas y provoco un gran daño al parásito. Esto fue más evidente cuando las amibas fueron incubadas con los flavonoides en un ambiente aeróbico, condiciones en las que el Camperol mostro un mayor efecto amebicida que el Metronidazol, sugiriendo que el Camperol puede tener una gran actividad amebicida en tejidos oxigenados.
Conclusiones
Los resultados muestran que los cambios ultraestructurales inducidos por Camperol incluyen cambios en el citoplasma, en el núcleo y alteración en la membrana citoplásmica de E. histolytica. Además, el Camperol provoco un daño al DNA similar al inducido por Metronidazol. Proponemos que estos efectos se deben a las características prooxidantes del Camperol, un efecto que supera los mecanismos anti-oxidantes de la amiba. Siendo la actividad anti-amibiana del Camperol mayor en condiciones de hiperoxigenación, sugiriendo que in vivo sería un mejor amebicida que el Metronidazol, dado que este fármaco disminuye su actividad en estas condiciones.
Agradecimientos: Los autores agradecen a los Drs. Alfonso Olivos-García† y Rafael Campos Rodríguez† por sus invaluables comentarios. El trabajo fue apoyado por SIP-IPN 20131262, 20221473.
REFERENCIAS