
Rev Med UAS
Vol. 12: No. 1. Enero-Marzo 2022
ISSN 2007-8013
José Blas Acosta-Escalante1, Damaris Monarrez-Manrriquez2, Fred Morgan-Ortiz2, María Guadalupe Guicho-Samaniego2, Everardo Quevedo-Castro2, Guadalupe López-Manjarrez3
*Autor de correspondencia: Dra. Damaris Monarrez Manrriquez
Domicilio: Prol. Álvaro Obregón 1422 Tierra Blanca, 80030 , Culiacán Rosales, Sinaloa
Telefono (667) 7580500 Email: Dra.damarismonarrez@hotmail.com
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v12.n1.002
Texto Completo PDFRecibido 18 de marzo 2021, aceptado 11 de octubre 2021
RESUMEN
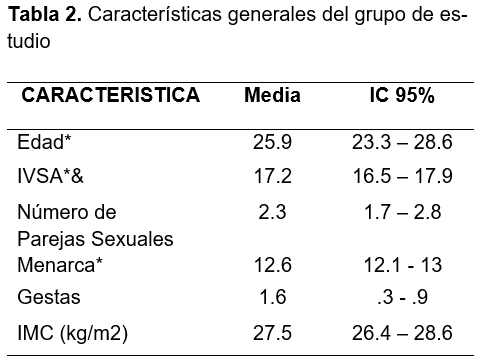
Objetivos: Estimar la prevalencia del virus del papiloma humano de alto riesgo en las pacientes con condilomas genitales. --- Material y Métodos: Se realizó una encuesta descriptiva en 56 pacientes con condilomas acuminados en área genital. A cada paciente se le tomó muestra de citología cervical para la detección de virus del papiloma humano mediante la reacción en cadena de la polimerasa (PCR). La prueba permite detectar 13 genotipos de VPH-AR 16, 18, 31, 33, 35, 39, 51, 52 56, 58, 59, 66 y 68. Esta prueba reporta, de manera separada a los otros 2 genotipos de alto riesgo, los genotipos 16 y 18. --- Resultados: La edad promedio en las pacientes fue de 26.5 (IC 95%: 23.3 - 28.6) con un inicio de vida sexual a los 17.2 años, (IC95%: 16.5 - 17.9), número de parejas sexuales de 2.3 (IC95%: 1.7 - 2.8). Los genotipos virales de VPH 31,33,35,52,58 (n=15) fueron los de mayor prevalencia con un 57.7% (IC 95%: 36.91 - 76.94, siguiéndole en frecuencia (n=11) el VPH-16 con 42.3% (IC95%: 23.35 - 63.08), los genotipos virales de VPH 39,56,66,68 con (n=7) con un porcentaje de 26.9% (IC 95%: 11.57 - 47.78). Con menor prevalencía el VPH-18 (n=6) con un 23.1% (IC95%: 8.97 - 43.64). Por último, los genotipos virales 51,59 con el 15.4% (IC95%: 4.35 - 34.86). --- Conclusiones: En base a los resultados del estudio, se puede afirmar que un número considerablemente alto de pacientes coexiste la infección por virus del papiloma humano de alto y bajo riesgo. En México los virus del papiloma humano 16 y 18 son los genotipos virales más asociado con cáncer cervicouterino y lesiones precancerosas. el estudio realizado muestra una mayor prevalencia de VPH considerados de riesgo intermedio para el desarrollo de cáncer cervicouterino. No existe evidencia estadísticamente significativa que nos indique una mayor prevalencia de VPH-AR en pacientes con condilomatosis.
Palabras clave:Virus del papiloma humano, genotipo viral, condilomatosis, Reacción en Cadena de la Polimerasa
ABSTRACT
Introduction: The present study describes the prevalence of high risk human papiloma virus in healty patients wiht vulvar condylomatosis. --- Objective: 1- Estimate the prevalence of high-risk viruses in patients with genital warts. Methodology Observational, descriptive, prolective study: descriptive survey. Fifty-six samples were analyzed in healthy patients with clinical presence of anogenital warts frome in a period from December 2017 to September 2019 in Culiacán, Sinaloa, Mexico. The test allows the detection of 13 genotypes of HPV 16, 18, 31, 33, 35, 39, 51, 52 56, 58, 59, 66 y 68. This test reports separately the other two high risk genotypes 16 and 18. --- Results: A total of 56 patients who presented clinical lesions compatible with human papillomavirus infection or such as genital warts or condylomata acuminata were analyzed. The average age of the patients was 26.5 (95% CI: 23.3 - 28.6) with an average body mass index of 27.5 Kg / m2 (95% CI: 26.4 - 28.6); the mean age of menarche was 12.6 years (95% CI: 12.1 - 13.0), with a start of sexual life at 17.2 years, (95% CI: 16.5 - 17.9), number of sexual partners of 2.3 (95% CI: 1.7 - 2.8) and the average number of pregnancies was 1.6 (95% CI: 0.3, 0.9) --- Conclusions: Analysis of the results suggests that there is no association between the presence of genital condylomatosis and high-risk human papillomaviruses. In contrast to other studies carried out, the viral genotypes with the highest prevalence correspond to the probe P3 HPV 31- 33- 35- 52- 58- which detected 57%. Second, the P1 probe for HPV 16 with a percentage of 42.3%
Keywords: Human papillomavirus, viral genotype, condylomatosis, genital anus warts
INTRODUCCIÓN
La infección por el virus del papiloma humano ha generado un alto impacto en países en vías de desarrollo, ya que este virus se ha reconocido como principal factor etiológico en cáncer cérvico-uterino.1 Mediante múltiples estudios epidemiológicos, moleculares y clínicos se ha demostrado que esta neoplasia es una consecuencia de una infección no resuelta, de ciertos genotipos de VPH.2
A nivel global el virus del papiloma humano, se considerada la infección de transmisión sexual más común, tanto en hombres como mujeres.
La mayor prevalencia de la infección por VPH ocurre principalmente dentro de la primera década después al inicio de la vida sexual activa, comúnmente entre la edad de 15 a 25 años en la mayoría de los países occidentales.3
Por largo tiempo se ha conocido que las infecciones genitales por VPH se transmiten por relaciones sexuales con penetración sin protección o por contacto físico cercano de piel a piel en una zona infectada. El contacto fomite, digital / anal y digital / vaginal probablemente también puede propagar el virus, aunque la evidencia de esto no es definitiva.4
Existe una amplia separación de los tipos de VPH según el riesgo asociado de cáncer de cuello uterino: a) Alto riesgo: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 y 68 y b) Bajo Riesgo: 6, 11, 40, 42, 43, 44, 53, 54, 61, 72, 73 y 81.5
Los tipos más comunes en todo el mundo son los tipos 16 y 18 del VPH, a su vez son serotipos virales que pueden ser prevenidos mediante vacunación; sin embargo, parece haber una variación geográfica en la distribución de los genotipos del VPH. En base al análisis de secuencia de DNA se han reconocido más de 100 genotipos de virus del papiloma humano causantes de un diverso rango de lesiones epiteliales.6
La prevalencia global de lesiones ano genitales causadas por VPH de bajo riesgo es del 0,15%-0,18%, se estima una incidencia que oscila entre 118 y 205 por 100.000 habitantes.11
La prevalencia de infección por VPH-AR en la población general es de 4.1% para pacientes con citología normal, y de un 19.3% para pacientes con lesiones verrugosas anogenitales, 37.7% para lesiones de alto grado y 63% para cáncer cervical.9
MATERIAL Y MÉTODOS
Se realizó una encuesta descriptiva sobre aspectos demográficos y antecedentes ginecobstetricos, en un total de 56 pacientes con lesiones en área genital, principalmente verrugas anogenitales y condilomatosis. Algunos de los datos recolectados durante el estudio fueron el inicio de vida sexual, numero de parejas sexuales, número de embarazos, índice de masa corporal y menarca. En estas pacientes se toma muestra de células exfoliativas del cuello uterino para la detección de virus del papiloma humano de alto riesgo mediante la reacción en cadena de la polimerasa PCR.
La toma de la muestra fue realizada por médicos, en pacientes que acuden a la consulta de displasia del hospital civil de Culiacán. Mediante un cepillo que se introduce en el canal endocervical. Este cepillo se coloca posteriormente en el tubo, que contiene el medio para su transporte al laboratorio. En el laboratorio, las células cervicales se someten a una solución alcalina desnaturalizante que expone el material genético. La amplificación de genes mediante PCR permite obtener millones de copias a partir de un fragmento de ADN particular. Posteriormente, mediante el uso de un cóctel de sondas de ARN correspondientes a los 13 tipos de VPH-AR 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68. En la tabla 1 se muestra el tipo de sonda utilizada y los subtipos de virus del papiloma que detecta
A cada estimador puntal se le calcularon intervalos de confianza del 95%. Con el propósito de hacer comparaciones internas de variables categóricas se utilizó la prueba Ji cuadrada para muestras independientes y prueba t de student.
RESULTADOS
Se analizaron un total de 56 pacientes que presentaron lesiones clínicas compatibles con infección por el virus del papiloma humano tales como verrugas genitales o condilomas acuminados. La edad promedio en las pacientes fue de 26.5 (IC 95%: 23.3 - 28.6) con promedio de índice de masa corporal de 27.5 Kg/m2 (IC95%: 26.4 - 28.6); la edad promedio de la menarca fue de 12.6 años (IC95%: 12.1 - 13.0), con un inicio de vida sexual a los 17.2 años, (IC95%: 16.5 - 17.9), número de parejas sexuales de 2.3 (IC95%: 1.7 - 2.8) y el promedio de número de embarazos fue de 1.6 (IC95%: 0.3, 0.9), el 65.38% de las pacientes fueron mayores de 35 años. (Tabla 2)
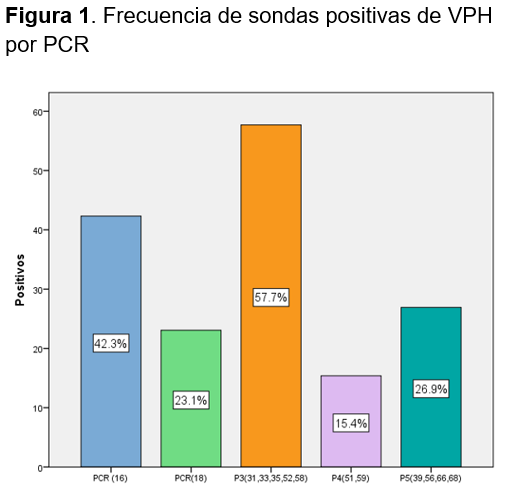
La sonda P3 que corresponde a los genotipos virales de VPH 31,33,35,52,58 fueron los de mayor prevalencia durante la realización del estudio con (n=15), un porcentaje de 57.7% y un (IC 95%: 36.91, 76.94). En orden de frecuencia la sonda P1 para genotipo de VPH 16 con (n=11) 42.3% y un (IC 95%: 23.35, 63.08). La sonda P5 para los genotipos virales de VPH 39,56,66,68 con (n=7) y un porcentaje de 26.9% y un (IC 95%: 11.57, 47.78). Con menor prevalecía la sonda P2 para genotipo viral de VPH 18 (n=6) mostro un porcentaje de 23.1% con un (IC 95%: 8.97, 43.64). Por último, la sonda P4 para genotipo virales 51,59 con 15.4% y un (IC 95%: 4.35, 34.86) (Tabla 1, Fig. 1)

DISCUSION
Los condilomas acuminados se presentan en el 1% de la población sexualmente activa, y se estima que un 75% de las mujeres estarán expuestas al virus del papiloma humano a lo largo de su vida, con una máxima incidencia a los 20 años de edad.3 La infección por VPH ha sido considerada como el factor de mayor riesgo para cáncer cervicouterino, ya que múltiples estudios han reportado que más de 99 % de las muestras con esta patología son positivas a VPH de alto potencial oncogénico.7
Estudios previos realizados en México han reportado la presencia de virus del papiloma humano entre un 95 y 98 % en pacientes con lesión intraepitelial escamosa de alto grado y cáncer cérvico uterino.5 En cuanto a lo que corresponde al grupo de mujeres sanas con citología cervical negativa, el virus se presenta en un 12.36%.8
A la fecha, alrededor de 200 genotipos de VPH han sido identificados; sin embargo, se ha reportado que aproximadamente 40 infectan el tracto ano-genital y solo los tipos de VPH-16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 y 59 han sido clasificados como carcinogénicos tipo 1, debido a la prevalencia y a los tipos virales encontrados en epitelio del cérvix normal y con cáncer. 12,13 Existen otros tipos virales como VPH-68, clasificado como probablemente carcinogénico, y los tipos de VPH 26, 30, 34, 53, -66, 67, 69, 70, 73, 82, 85 y 97 clasificados como posiblemente carcinogénicos.13
A nivel mundial, los tipos más frecuentemente asociados a tumores malignos de cérvix son VPH-16, 18 y 45 6 El presente estudio pretende determinar la prevalencia y asociación de VPH con potencial oncogénico, en pacientes que además presentan lesiones clínicas compatibles con VPH no oncogénico.
El análisis de los resultados sugiere que no existe asociación entre la presencia de condilomatosis genital y los virus del papiloma humano de alto riesgo. En contraste con otros estudios realizados los genotipos virales con mayor prevalencia corresponden a la sonda P3 VPH 31- 33- 35- 52- 58- la cual detecto un 57%. En segundo lugar, la sonda P1 para VPH 16 con un porcentaje de 42.3 %.
En tercer lugar, se encuentra la sonda P5 para VPH 39- 56- 66- 68 con un porcentaje de 26.9. En cuarto lugar, tenemos la sonda P2 correspondiente a VPH 18 con un porcentaje de 23.1%.
La detección de VPH puede realizarse mediante pruebas directas que permiten la identificación del genoma de VPH de alto riesgo, o por medio de amplificación de un fragmento de ADN viral, con o sin genotipificación.7 Las primeras identifican de manera directa el ADN de algunos de los 13 tipos de VPH que son considerados carcinogénicos sin realizar amplificación previa del ADN. Las segundas amplifican un fragmento del ADN viral mediante la reacción en cadena de la polimerasa (PCR) para obtener millones de copias del mismo tanto de manera convencional como en tiempo real. Las pruebas de genotipificación permiten identificar los tipos virales de manera específica, usualmente el VPH 16 y 18 y las de ARNm identifican la expresión de los genes de las oncoproteínas E6 y E7 del VPH. 4
La técnica de PCR en tiempo real se ha introducido en los últimos años en el diagnóstico molecular del VPH como herramienta para la determinación cuantitativa de la carga viral, así como para el diagnóstico de la infección.19
CONCLUSIONES
En México la infección por virus del papiloma humano es la enfermedad de transmisión sexual más frecuente tanto en hombres como mujeres. se debe tomar en cuenta que la presencia de ADN viral no significa lesión precursora o infección activa ya que la mayoría de las mujeres la infección es transitoria, sobre todo en mujeres jóvenes.
Los genotipos virales que se han detectado en pacientes con lesiones precursoras o cáncer cervicouterino corresponden a los siguientes 16,18, 31, 33, 35, 52, 58, 51, 59, 39, 56, 66, 68 con mayor prevalencia los dos primeros
En las muestras analizadas se identificó la presencia de virus del papiloma humano de alto riesgo oncogénico anteriormente mencionados, presentes en pacientes sanas sin lesiones precursoras o cáncer cervicouterino.
En base a los resultados del estudio, se puede afirmar que un número considerablemente alto de pacientes coexiste la infección por virus del papiloma humano de alto y bajo riesgo.
En México los virus del papiloma humano 16 y 18 son los genotipos virales más asociado con cáncer cervicouterino y lesiones precancerosas. el estudio realizado muestra una mayor prevalencia de VPH considerados de riesgo intermedio para el desarrollo de cáncer cervicouterino.
La detección de genotipos virales del papiloma humano de alto riesgo mediante PCR, tiene como desventaja la tipificación por grupos, para algunos de los genotipos virales mientras que para otros lo hace por separado.
REFERENCIAS