
Rev Med UAS
Vol. 11: No. 2. Abril-Junio 2021
ISSN 2007-8013
Luis Gerardo Ricardez-Cazares1*, Martha Adriana González-Fernández2, Edgar Dehesa-López3, Felipe Peraza-Garay4
*Autor de correspondencia: Dr. Luis Gerardo Ricardez-Cazares.
Calle Josefa Ortiz de Domínguez 1759 int 2. Col. La Lima. CP 80040. Culiacán, Sinaloa, México.
Cel. 6391069895 e-mail: luis.ricardez.czs@live.com.mx
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v11.n2.002
Texto Completo PDFRecibido 12 de Enero 2021, aceptado 18 de Febrero 2021
RESUMEN
Objetivo: Comparar la escala de Rotterdam contra la escala de Marshall durante la evaluación inicial del traumatismo craneoencefálico y determinar cual tiene un mejor valor predictivo de desenlace (GOS). --- Materiales y métodos: Se realizó un estudio transversal, observacional y prospectivo en el área de imagenología del Hospital civil de Culiacán, durante el año 2017 con una muestra de 90 pacientes, para detectar una diferencia en el AUC ROC de 0.13 en pacientes con TCE moderado a grave a los que se les realizó tomografía de cráneo simple que fueron evaluadas con las escalas de Marshall y Rotterdam. Para comparar los niveles de Escala de Glasgow de Desenlace (GOS) con la de Rotterdam se utilizó un ANOVA de una vía y la prueba de Kruskall-Wallis con la de Marshall. --- Resultados: Un total de 90 pacientes, 86.7% hombres y 13.3% mujeres fueron reclutados para el estudio. La edad promedio fue de 34.3 años. El valor promedio de GCS fue de 9.5 con una tasa de mortalidad de 12.2%. El área bajo la curva (AUC) para Marshall fue de 0.932 y de 0.956 para Rotterdam. --- Conclusión: Ambas escalas muestran un adecuado poder predictivo para desenlace con respecto a incapacidad severa, estado vegetativo y muerte en pacientes con traumatismo craneoencefálico moderado y severo. Por lo que pueden ser utilizados en la clínica de manera confiable.
Palabras clave:TCE, Rotterdam, Marshall, GOS, Tomografía.
Objective: Determinate if the Rotterdam scale represents an significative improvement as an outcome predictor against the Marshall scales for TBI. --- Materials and methods: A transversal, observational, prospective. Study underwent in the radiology department of the “Hosital Civil de Culiacan” from January to December of 2017. With a simple size of 90 patients, to detect a difference in the AUC ROC of 0.13. in patients with mild to severe BHT which underwent head CT and were evaluated with. Both Rotterdam and Marshall scales. In order to compare the Glasgow Outcome Scale (GOS) with the Rotterdam scale we use one-way ANOVA and Kruskall-Wallis test for the Marshall scale. --- Results: A total of 90 patients, 86.7% males and 13.3 females were recruited for this study. With a mean age of 34.3 years. The average for GCS upon arrival was 9.5 con with a mortality rate of 12.2%. Both scales show adequate discriminative power to predict outcomes from severe disability to early mortality. Without significative difference between Marshall (AUC 0.932) and Rotterdam (AUC 0.956). --- Conclusion: Both scales show adequate discriminative power to predict outcomes with respect to severe disability, vegetative state and death in patients with traumatic brain injury and can be use in clinical setting with confidence. Key words: TBI, Rotterdam, Marshall, GOS, Tomography
INTRODUCCIÓN
El traumatismo craneoencefálico (TCE) es una de las principales causas de consulta en los servicios de urgencia a nivel global, la escala de coma de Glasgow (GCS) se ha utilizado como base para estratificarlo en su evaluación inicial, introducida por Teasdale y Jennett en 19741. El TCE se asocia a una morbimortalidad significativa a largo plazo, y la neuroimágen forma un papel crítico en su manejo, ya que permite identificar distintos niveles de lesión encefálica inducida por el trauma2.
A nivel mundial se presentan 1.2 millones de fallecimientos anuales y 20 a 50 millones de traumatismos no letales, lo cual lo convierte en la Primer causa de discapacidad a nivel mundial. En México tiene un índice de mortalidad de 38.8 fallecimientos por cada 100 mil habitantes, convirtiéndose en la tercera causa de muerte, presentando su mayor incidencia en hombres entre los 15 y 45 años. De los sobrevivientes una tercera parte presentará secuelas importantes y solamente el 40% de los lesionados se reincorporará a su vida laboral.3
La GCS se considera como un buen indicador pronóstico, sin embargo, los estudios que analizan esta característica difieren en el momento adecuado para su realización teniendo en cuenta el proceso fisiológico desencadenado por la lesión.4
El método de imagen de elección para la valoración de lesiones asociados a TCE, es la tomografía computarizada (TC),5 la presencia de hallazgos agudos en la tomografía y una disminución en la GCS, se asocian con una peor evolución a largo plazo en el intervalo de 6 meses. Las escalas de Marshall (Tabla 1) y de Rotterdam (Tabla 2) nos permiten evaluar el grado de severidad de las lesiones desde el punto de vista radiológico.

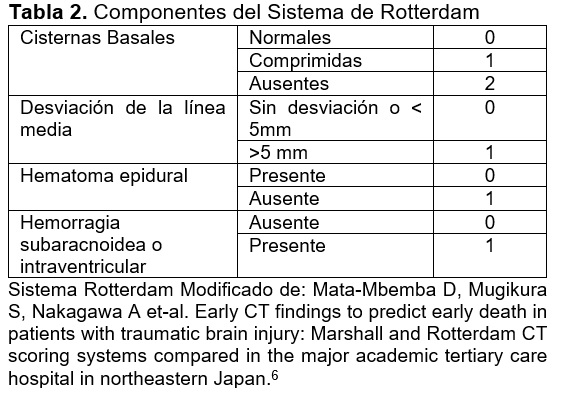
La escala de Marshall, que nos permite describir la TC inicial y nos ayuda a pronosticar la evolución.7 Desde el punto de vista tomográfico las lesiones se van a clasificar como difusas, focalizadas, o en efecto de masa, mientras las lesiones difusas, no presenten incremento de volumen por lo general tendrán un mejor pronóstico.8
Bobinski compara la efectividad de ambas escalas al asociar sus puntajes durante la TC inicial y la TC a las 24 horas, con la escala de desenlace de Glasgow GOS (Tabla 3) a 3, 6 y 12 meses. Demostrando, un valor pronóstico estadísticamente significativo de la TC inicial.9 La escala de Rotterdam facilita su utilización en el seguimiento de las lesiones a través del tiempo. Mientras tanto en la evaluación de las hemorragias intraparenquimatosas se encontró una relación directa entre el volumen y el puntaje en la escala de Marshall, cuanto mayor sea la lesión, ésta tenderá a incrementar su volumen más rápido, mientras tanto las lesiones pequeñas tenderán a permanecer estables. Otra limitante de la escala de Marshall es la linealidad sobre las variables a evaluar, y la necesidad de conocer el estado postquirúrgico del paciente. Mientras que con la escala de Rotterdam cada hallazgo se evalúa y califica de manera individual y se suman para una evaluación final. Ambos sistemas de medición han presentado un adecuado desempeño como predictores de mortalidad temprana.10
Las indicaciones para la realización de la TC de seguimiento quedan a criterio médico de tratante.11 La ausencia de lesiones en la imagen inicial, no se contrapone contra la necesidad de un estudio de seguimiento en caso de deterioro neurológico.12
Es importante mencionar que, como las escalas de evaluación por TC, requieren de la valoración por parte de un médico radiólogo, la variabilidad en inter observador es posible, en este caso, los componentes de la escala de Marshall aun cuando son pragmáticos, presentan una ligera desventaja comparativa, con respectó al sistema de Rotterdam.13
Existen factores importantes que tienen que ver con la probable recuperación a largo plazo de un paciente por TCE moderado a severo, como la edad, nivel socioeconómico, grado académico, situación laboral, aquellos individuos que se encontraban con un trabajo estable, presentan mejor recuperación que aquellos que se encontraban desempleados al momento del accidente.14
Para evaluar la recuperación de estos individuos hasta el momento la herramienta válida con la que contamos es con la escala de desenlace de Glasgow (GOS), la cual puede ser aplicada desde el egreso, y durante revisiones continuas, un adecuado seguimiento, nos permite plantear modificaciones en el proceso de rehabilitación de cada paciente y de esa forma mejorar su calidad de vida.15
El objetivo del estudio es determinar si la escala de Rotterdam es mejor para predecir desenlace (GOS) en pacientes con TCE contra la escala de Marshall.
Material y Métodos
El estudio se llevó a cabo con pacientes de 17 años o más a quienes se les realizó tomografía de cráneo simple con diagnóstico de TCE moderado a grave durante las primeras 24 horas en el Hospital Civil de Culiacán, durante el periodo comprendido 1 de enero de 2017 a 31 de diciembre de 2017. Se excluyeron pacientes politraumatizados con heridas extracraneales severas y pacientes con heridas penetrantes de cráneo y se eliminaron aquellos con estudios técnicamente defectuosos.
Se utilizó para la adquisición de las imágenes, un equipo tomográfico marca Siemens modelo Somatom Perspective con 64 detectores.
Se utilizó un sistema PACS (Picture Archiving and Comunication System) basado en DICOM para el envío electrónico del conjunto de imágenes hacia el procesador, utilizando el programa Horos V3.3.5 para visualizar cada uno de los estudios, realizando las reconstrucciones multiplanares requeridas.
El médico radiólogo adscrito al servicio de tomografía evaluó la tomografía de cráneo inicial (obtenida durante las primeras 24 horas posteriores al traumatismo) con la escala de Marshall (tabla 1) y Rotterdam (tabla 2). Se evaluó GOS al momento del egreso.
Análisis estadístico
Se calculó el tamaño de muestra con una potencia de 0.80 para detectar una diferencia de 0.13 entre el área bajo la curva ROC bajo la hipótesis de 0.67 basado en la publicación original de Rotterdam 8 usando una prueba Z bilateral y un nivel de significancia 0.05. El área bajo la curva AUC fue calculada para una tasa de falsos positivos entre 0 y 0.2.
Para comparar los niveles de GOS en la escala Rotterdam se utilizó un ANOVA de una vía y la prueba de Kruskall-Wallis en la escala de Marshall. Se estimó el área bajo la curva con intervalos de confianza del 95%. Un valor de p<.05 se consideró estadísticamente significativo. Los datos fueron analizados en SPSS v23.
Resultados
Un total de 90 pacientes, 86.7% hombres (78) y 13.3% mujeres fueron reclutados para el estudio. La edad promedio fue de 34.3 18.64 años. La edad promedio de los pacientes fallecidos fue 12 años mayor con respecto a los vivos. El valor promedio de GCS fue de 9.48 3.38 existiendo una diferencia significativa entre el valor de GCS entre vivos y muertos (Tabla 3). La tasa de mortalidad fue de 12.2%.
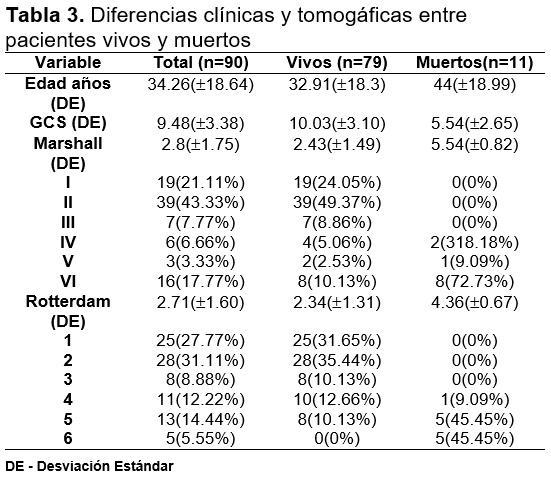
La mortalidad se incrementó con el aumento en los puntajes de ambas escalas, sin embargo, se mostró un leve descenso en aquellos dentro de la variable V en la escala de Marshall (lesión evacuada) como era de esperarse. Los puntajes en ambas escalas fueron mayores en los pacientes muertos.
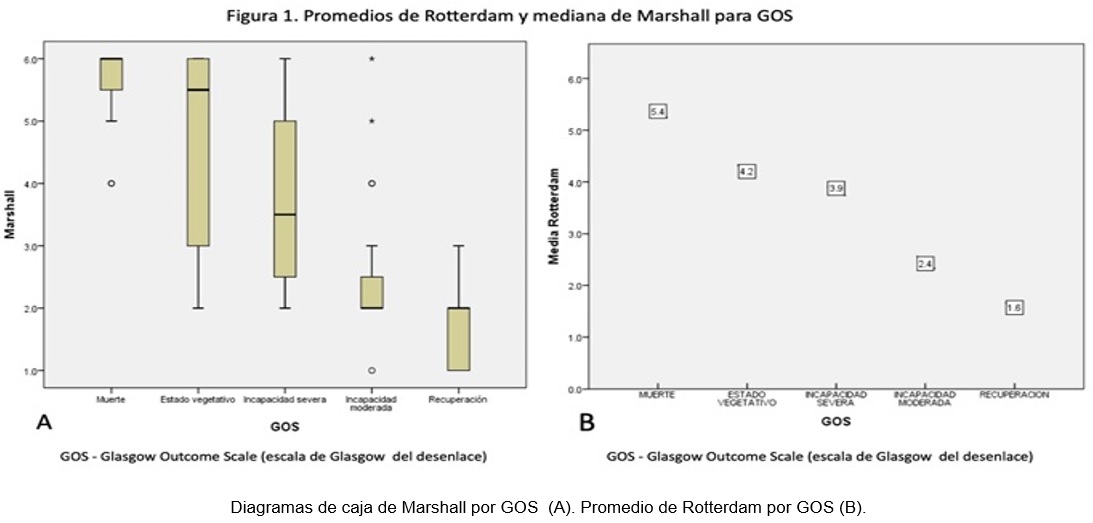
El puntaje ambas escalas mostraron una relación inversamente proporcional con respecto a los puntajes de GOS, mientras que el puntaje de GCS presentó relación directamente proporcional con el GOS (figura 1).
El área bajo la curva para la escaña de Marshall fue de 0.932 (0.876 –0.989) y para Rotterdam de 0.956 (0.917 – 0.996) con base en las coordenadas de la Curva COR se establecieron los puntos de corte para valores de Rotterdam mayor a 3 y de Marshall mayor a 2.
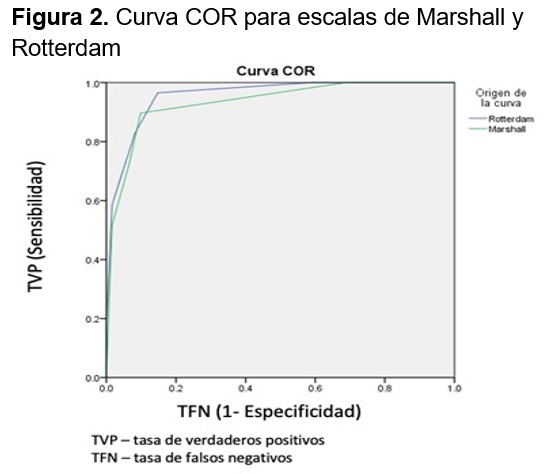
Con valores de Rotterdam mayores o iguales a 3 se obtuvo una sensibilidad del 94%, especificidad de 83.5%, un valor predictivo positivo (VPP) de 58.6% y un valor predictivo negativo (VPN) de 98.4% y una exactitud del 85.6% con un intervalo de confianza del 95%. Mientras que con valores de Marshall mayores a 2 se obtuvo una sensibilidad del 81.3%, especificidad de 94.8%, un VPP de 89.7 y un VPN de 90.2% y una exactitud del 90% con un intervalo de confianza del 95%, para mortalidad
Discusión.
Los reportes epidemiológicos a nivel global muestran que el traumatismo craneoencefálico generalmente afecta a hombres jóvenes, con buen estado de salud,7 en nuestro estudio se corrobora con una proporción de 6:1 con respecto a mujeres. La edad promedio fue de 34 años con afectación a individuos en edad económicamente activa. Los resultados de la evaluación por GOS al momento del egreso fue el siguiente, las defunciones representaron el 12.08%, estado vegetativo 10.98% e incapacidad severa 8.79%. Lo anterior implica desenlaces graves en al menos 31.85 % de los pacientes incluidos en el estudio, a demás de los desenlaces fatales el resto de los pacientes cursan con periodos de hospitalización prolongados y secuelas que requerirán de largos periodos de rehabilitación, que además de un elevado costo conllevan periodos de incapacidad temporal o permanente, que representan un fuerte impacto a la economía familiar y de la comunidad.3
Actualmente se han desarrollado múltiples escalas para la evaluación del traumatismo craneoencefálico basadas en hallazgos tomográficos, considerando escalas de evaluación clínicas previas a la realización de estudios de imagen con la finalidad de disminuir la exposición a la radiación ionizante en aquellos pacientes en los que se pueda prescindir de dicha exploración como la escala de coma de Glasgow o la escala de FOUR.16 En aquellos pacientes a los que si se realiza Tomografía de cráneo la escala de Marshall ha demostrado ser un predictor de desenlace fuerte para el traumatismo craneoencefálico severo en adultos. Siendo un sistema pragmático y ampliamente utilizado de manera global a pesar de sus limitaciones. Mientras tanto la escala de Rotterdam desarrollada mas recientemente utiliza la combinación múltiples hallazgos tomográficos y su adición para predecir el desenlace, aun cuando supera algunas de las limitaciones de la escala de Marshall, aun no ha sido ampliamente validada.
Se seleccionó el punto de corte a partir de discapacidad severa con base en el tamaño de la muestra. En el estudio ambas escalas mostraron una precisión similar con una diferencia de área bajo la curva de 0.024 con un punto de corte para establecer diferencia significativa con una diferencia del área bajo la curva mayor. A 0.13 basado en el estudio original de Mass.8 para predecir desenlace desde incapacidad severa hasta la muerte, mientras que la literatura refiere superioridad del sistema Rotterdam, no encontramos diferencia estadísticamente significativa entre ambas escalas.
Las escalas de evaluación tomográfica evaluadas no incluyen hallazgos que pudieran tener repercusión clínica, como la distribución de la hemorragia subaracnoidea, el tipo de colección (hematoma subdural o epidural), la presencia de infarto en tallo encefálico, que, si pueden ser evaluados por tomografía, o los casos de lesión axonal difusa, la cual solo puede ser valorada adecuadamente por resonancia magnética. Algunas de estas limitaciones son abordadas por clasificaciones como la de Helsinki y la de Estocolmo, pero ambas aun requieren de validación externa.10
Dentro de las limitaciones de nuestro estudio consideramos la falta de seguimiento a mediano y largo plazo, lo cual podría aportar más información sobre la evolución y mejoría de los pacientes con valores de la escala de GOS para incapacidad severa y moderada al momento del egreso hospitalario, así como lo sugieren estudios como el de Oliveira en el cual los pacientes con discapacidad moderada al egreso muestran mejoría significativa en las evaluaciones a 3 y 12 meses.15 Así mismo no de ajustaron los hallazgos a factores predictores previamente establecidos como la edad, hipoxia e hipotensión debido al pequeño de la muestra.
Conclusión.
Tanto la escala de Marshall como el sistema Rotterdam muestran un adecuado poder predictivo para desenlace con respecto a incapacidad severa, estado vegetativo y muerte en pacientes con traumatismo craneoencefálico moderado y severo. De tal forma que ambas escalas pueden ser utilizadas en la practica clínica de manera confiable. Futuras escalas se pueden beneficiar de la inclusión de mayores detalles con respecto a las características de la hemorragia subaracnoidea o la adecuada diferenciación de hematomas.
REFERENCIAS