Rev Med UAS
Vol. 11: No. 1. Enero-Marzo 2021
ISSN 2007-8013
Mendoza-Hernández Cristian1, Medina-de la Cruz Omar1, Díaz-Palma Rosa María1, Carranza-Betancourt Oswaldo1, Gallegos-García Marisol2, Escoto-Chávez Saúl Enrique2, Gallegos-García Verónica1*
*Autor de correspondencia: Gallegos-García Verónica
Dirección: Av. Niño Artillero No. 130. Zona Universitaria. C.P. 78240. veronica.gallegos@uaslp.mx
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v11.n1.004
Texto Completo PDFRecibido 22 de Octubre 2020, aceptado 26 de Noviembre 2020
RESUMEN
Introducción. Los aceites esenciales tienen una gran cantidad de compuestos que poseen efecto fungicida y en los últimos años se ha considerado su uso como posibles tratamientos que permitan el control de infecciones. Candida albicans es parte de la microbiota y es una levadura patógena de importancia médica que en ciertas patologías como neoplasia intraepitelial cervical (NIC), diversos cánceres y pacientes con el síndrome de inmunodeficiencia humana puede ocasionar infecciones superficiales o sistémicas. --- Objetivo. Evaluar el efecto fungicida de Chrysactinia mexicana A. Gray sobre aislados clínicos de C. albicans de mujeres potosinas con diferentes grados de NIC. --- Material y métodos. Se extrajo el aceite esencial de Chrysactinia mexicana A. Gray por arrastre de vapor. Se utilizó la técnica de microdilución en placa de 96 pozos para conocer la concentración fungistática y fungicida del aceite esencial y el acetato de linalilo. Se realizaron ensayos de 24h, fase estacionaria y logarítmica de crecimiento sobre 11 aislados clínicos de C. albicans de pacientes con NIC y una cepa ATCC. Posteriormente se observó el crecimiento en cajas de Petri con YPD agar por 48h. --- Resultados. Se observó un efecto fungicida sobre las cepas Ca7 y SC5314 de C. albicans con 3.71mg/ml y 4.64mg/ml respectivamente. La Ca7 de C. albicans mostro inhibición del 100% tubo germinal a la concentración de 0.371mg/ml del aceite esencial de C. mexicana. --- Conclusiones. El aceite esencial de C. mexicana tiene efecto fungicida y fungistático en aislados clínicos de pacientes con NIC.
Palabras Clave: Acetato de linalilo, tubo germinal, fungicida, fungistático
ABSTRACT
Introduction. Essential oils have a large number of compounds that have a fungicidal effect and in recent years their use has been considered as a possible treatment that allows infection control. Candida albicans is a part of the microbiota and is a pathogenic yeast of medical importance that in certain pathologies, such as cervical intraepithelial neoplasia (CIN), various cancers, and patients with human immunodeficiency syndrome, can cause superficial or systemic infections. --- Objective. To evaluate the fungicidal effect of Chrysactinia mexicana A. Gray on clinical isolates of C. albicans from female patients in San Luis Potosi with different degrees of CIN. --- Material and Methods. The essential oil of C. Mexicana was extracted by steam entrainment. The 96-well plate microdilution technique was used to determine the fungistatic and fungicidal concentration of the essential oil and linalyl acetate. 24 h, stationary and logarithmic growth phase tests were performed on 11 clinical isolates of C. albicans from patients with CIN and ATCC strain. Subsequently, growth was observed in petri dishes with YPD agar for 48h. --- Results. A fungicidal effect was observed in C. albicans strains Ca7 and SC5314 with 3.71mg/ml and 4.64mg/ml respectively C. albicans Ca7 showing 100% inhibition of the germ tuve at the concentration of 0.37mg/ml of the essential oil of C. mexicana. --- Conclusions. The essential oil of C. mexicana has a fungicidal and fungistatic effect in clinical isolates from patients with CIN.
Keywords:Linalyl acetate, germ tuve, fungicide, fungistatic
INTRODUCCIÓN
La Neoplasia Intraepitelial Cervical (NIC) es una lesión precursora del Cáncer Cervicouterino (CaCu) que ha sido ampliamente estudiada. Se caracteriza microscópicamente por una serie de cambios que van desde la atipia celular a distintos grados de NIC antes de su progresión a CaCu1. Se sabe que la infección persistente por Virus del Papiloma Humano (VPH) es el factor de riesgo necesario para el desarrollo de NIC, aunque existen otros co-factores intrínsecos como el microambiente vaginal que contribuyen a la carcinogénesis1.
Entre estos co-factores se encuentra el valor del pH, la higiene, la presencia de H202, β-glucoronidasa, coagulasa, neuraminidasa, esteresa de leucocitos y la disbiosis contribuyen al desarrollo de estas neoplasias2. Un estudio demostró que la tasa normal de neuraminidasa fue significativamente más alta en pacientes con NIC, además se observó que la actividad de la esterasa leucocitaria en pacientes con presencia de candidiasis vaginal recurrente y vaginitis bacteriana fue mayor respecto a las mujeres sanas2.
La microbiota influye en funciones fisiológicas que van desde mantener la homeostasis, la regulación del metabolismo, la hematopoyesis, la inflamación y la inmunidad. Pero durante el proceso cancerígeno se producen cambios en los puntos de control inmunitarios del microambiente que crea las condiciones favorables para la carcinogénesis, la desregulación de la integridad de las células epiteliales conduce a una mayor susceptibilidad a infecciones de patógenos oportunistas como las especies del género Candida3.
Se han descrito alrededor de 200 especies de Candida¸ aunque un número limitado tienen la capacidad de originar un efecto patógeno en el humano, en el ámbito hospitalario se identifican con mayor frecuencia Candida albicans y Candida spp., aunque esto tiene variaciones según la zona geográfica4. Estas forman parte de la microbiota del tracto gastrointestinal y vagina, poseen características que les permiten adaptarse a diferentes microambientes y actuar como un patógeno oportunista5.
Dentro de estas características destacan la adaptación a cambios de pH, lo cual le permite vivir en el pH ácido de la vagina, estas levaduras también tienen adhesinas que les permiten adherirse a diferentes células entre ellas las epiteliales, uno de sus factores de virulencia es la transición morfológica de blastoconidios a pseudohifas o hifas verdaderas dependiendo de la especie de Candida6,7.
La especie de Candida que se aísla con mayor frecuencia es C. albicans, la mayoría de las infecciones por estos microorganismos se originan por la acumulación de diferentes factores de riesgo, la interacción con otros microorganismos presentes en la mucosa vaginal y la cantidad total de microorganismos presentes, esta levadura presenta susceptibilidad al tratamiento con fluconazol, sin embargo se ha reportado en estudios con aislados clínicos con tratamientos azólicos prolongados que con el tiempo ha disminuido4,8.
La prevalencia de candidiasis, la susceptibilidad en las pacientes con diagnóstico de NIC y la resistencia de C. albicans al tratamiento de elección permite la búsqueda de nuevas alternativas para el tratamiento y control de esta infección. Los extractos y aceites esenciales derivados de plantas resultan ser una excelente propuesta terapéutica, aunque un punto importante a considerar es el uso de plantas nativas de la región, que favorezcan realizar ensayos in vitro e in vivo, por el fácil acceso a la materia vegetal9.
La planta Chrysactinia mexicana A. Gray ha sido estudiada por sus actividades biológicas como: insecticida, antidiarreica, expectorante, anticolinérgica, afrodisiaca y antifúngica10. Actualmente no hay reportes con el aceite esencial de C. mexicana sobre C. albicans por lo tanto el objetivo de la investigación fue evaluar el efecto fungicida de C. mexicana sobre aislados clínicos de C. albicans de mujeres con diferentes grados de NIC.
Material y métodos
Recolección de la materia vegetal
C. mexicana (Asteraceae) en etapa de floración se recolectó en el mes de julio del año 2016 en el municipio de Guadalcázar de San Luis Potosí en las coordenadas 22°36´30.2” N 100°26´50.2” O. El material vegetal fue autentificado por el taxónomo José García Pérez con el código SLPM37571 depositado en el herbario del instituto de zonas desérticas de la Universidad Autónoma de San Luis Potosí.
Obtención de aceite esencial
El material vegetal se secó a temperatura ambiente por 72h, se separaron las flores, las hojas y las ramas secundarias; se trituraron y se realizó la molienda en seco para obtener una partícula de 1.75mm para la homogenización de la muestra. El aceite esencial se extrajo por la técnica de destilación por arrastre de vapor, para separar el aceite esencial del agua floral se utilizó la técnica de separación por densidades con un embudo de separación11.
Microorganismos utilizados
Las cepas utilizadas fueron 11 aislados clínicos que se recuperaron de muestras cervicales de pacientes con diagnóstico de candidiasis vaginal y distintos grados de NIC y una cepa ATCC.

Medio de cultivo
Las cepas fueron cultivadas en medio líquido de levadura-peptona-dextrosa (YPD) 1% de extracto de lavadura (BD Bioxon), 2% peptona (BD Bioxon) y 2% de glucosa (Fermont). El medio YPD sólido se preparó adicionando 2% de agar (BD Bioxon). Los cultivos líquidos se mantuvieron a una temperatura controlada de 28°C en un agitador orbital a 120rpm durante 24h o 48h según el experimento.
Caracterización de los aislados clínicos de C. albicans
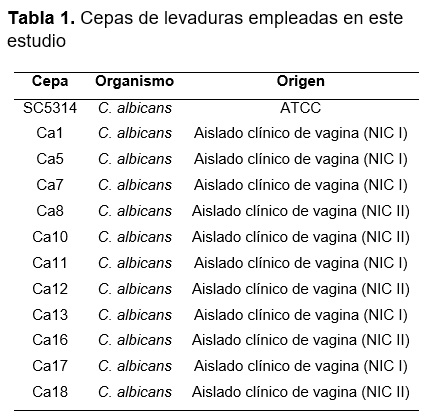
Se realizó la prueba de tubo germinal en plasma fresco para lo cual se tomó una colonia de C. albicans que se creció previamente en medio YPD solido por 24h a 30°C, la colonia se inoculó en 1ml de plasma fresco que se incubo a 37°C durante 3h (Incubadora Wiseven® modelo: WOF-105). Posteriormente las células se observaron en un microscopio de campo claro con un aumento de 100x. (Microscopio Carl Zeiss® modelo: Primo Star).
Se realizó una prueba enzimática en CHROmagar Candida® en donde se crecieron de manera independiente cada aislado clínico y se incubaron a 30°C durante 48h, se observó y registro el cambio de color de las colonias. El color esperado para C. albicans fue verde claro.
Ensayos de crecimiento en fase logarítmica o estacionaria y de 24h de C. albicans
A partir de un cultivo de 48h se inoculó la cepa a OD600nm 0.5 en 10ml de YPD líquido y se agregaron las concentraciones del aceite esencial en cada uno de los tubos desde 0.46mg/ml a 4.64mg/ml (p=0.9290 g/cm3) de aceite esencial de C. mexicana, se adicionó como diluyente Dimetilsulfoxido (DMSO) al 1.25% como disolvente del aceite esencial y se incubaron por 24h a 28°C a 120rpm. El control contenía o no DMSO al 1.25% del volumen final para verificar que no tiene efecto sobre el crecimiento de C. albicans. Se utilizó el agua floral extraída y se probó sobre la cepa Ca7 para conocer si tenía algún efecto en la cual se utilizaron 8 µl, 16µl y 32µl. Se probaron las concentraciones de 20mg/ml-40mg/ml del acetato de linalilo (W263605 Sigma-Aldrich) que es uno de los compuestos mayoritarios del aceite esencial de C. mexicana11 y se utilizó como diluyente del compuesto etanol al 70%.
Los cultivos se incubaron a 28°C con agitación continua a 120 rpm durante 7 h y 24h en medio nuevo (fase logarítmica de crecimiento) o durante 3 h en medio recuperado de fase estacionaria (fase estacionaria de crecimiento), transcurrido el tiempo de incubación se determinó la densidad óptica y se ajustó a OD600nm 0.5 en 1 mL de agua destilada estéril, posteriormente se lavaron las células y se centrifugaron a 13,000 rpm durante 30 seg y se realizaron ensayos de microdilución12 en placas de 96 pocillos y una alícuota de 180µL se colocaron en cajas de Petri con medio YPD agar durante 48 h.
Efecto del aceite esencial de C. mexicana sobre la morfología de C. albicans
Incubación de C. albicans con el aceite esencial
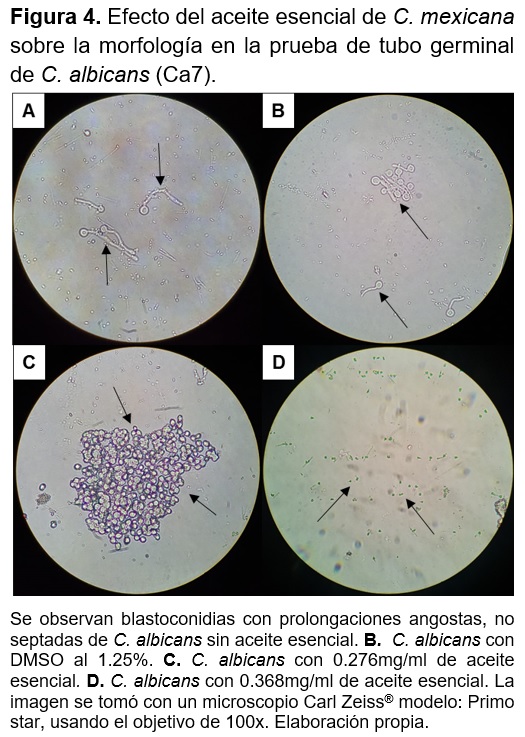
A partir de un cultivo de 48h del aislado clínico Ca7 se tomó la cantidad necesaria para tener OD600nm 0.5 de C. albicans en 1ml de plasma y se colocó en un tubo con 0.278mg/ml de aceite esencial de C. mexicana Gray, se preparó otro tubo con 0.371mg/ml de aceite esencial, en ambos tubos se les adiciono DMSO al 1.25% como disolvente y como controles se incluyó un tubo con C. albicans sin aceite esencial y uno con C. albicans y DMSO al 1.25% sin aceite esencial.
Los tubos se incubaron a 37oC por 3h, después se centrifugaron a 13,000rpm por 30s y se decantó el sobrenadante, la pastilla se resuspendió en 1ml de agua destilada estéril y la preparación se observó mediante un microscopio de campo claro a un aumento de 100x, y las levaduras e hifas se cuantificaron en cámara de Neubauer.
Resultados.
Caracterización de los aislados clínicos
Se caracterizaron los aislados clínicos con la prueba de formación de tubo germinal donde se observó que los aislados clínicos mostraron el cambio morfológico (Figura 1A). La prueba bioquímica con CHROmagar Candida mostró colonias con un color verde claro lo cual concuerda con C. albicans (Figura 1B).
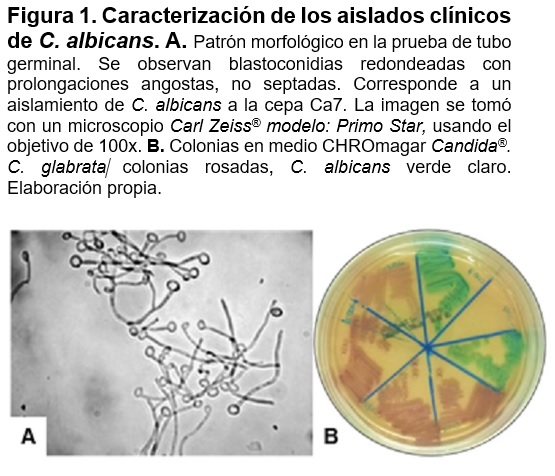
Efecto de aceite esencial en ensayos de 24h sobre aislados clínicos de C. albicans
El aislado clínico Ca7 y la cepa ATCC SC5314 en presencia del aceite esencial tuvo un efecto fungicida, mientras que en los aislados Ca8, Ca11, Ca16 y Ca17 se muestra un efecto fungistático ya que se observó que en la dilución de 10-3 existe una disminución en el número de unidades formadoras de colonias (Figura 2). Para las cepas Ca1, Ca5, Ca10, Ca12, Ca13 y Ca18 las concentraciones del aceite esencial de C. mexicana, no presentan ningún efecto. En los ensayos del agua floral esta no tiene efecto sobre el crecimiento de la cepa Ca7 (Figura 2).
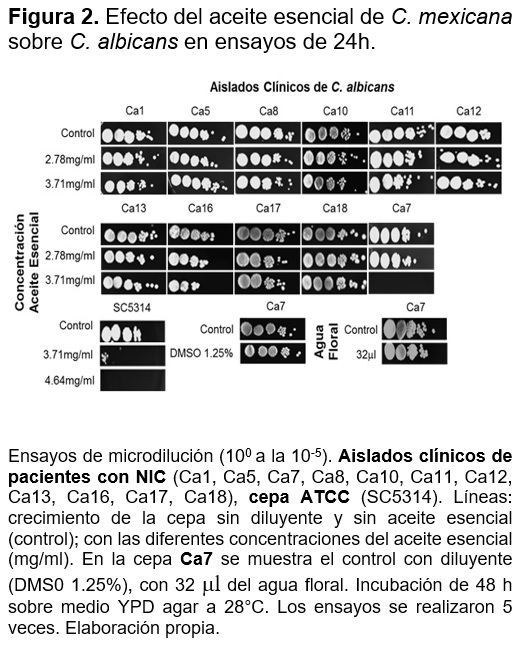
Efecto de aceite esencial y acetato de linalilo sobre C. albicans
Para conocer en qué etapa de crecimiento la cepa SC5314 en interacción con el aceite esencial tenía el efecto fungicida, se realizaron ensayos en fase logarítmica (FL) y estacionaria (FE) de su crecimiento (Figura 3A), el efecto fungicida se observa en 4.64mg/ml en FE y para la FL fue de 3.71mg/ml. Para el acetato de linalilo uno de los principales compuestos del aceite esencial se probó en ensayos de 24 h, FE y FL de crecimiento (Figura 3B), se observa que a la concentración de 30mg/ml hay un efecto fungicida sobre C. albicans.
Efecto del aceite esencial de C. mexicana sobre la morfología de C. albicans
El aceite esencial de C. mexicana tiene efecto inhibitorio sobre la formación del tubo germinal en la cepa Ca7 a una concentración de 0.278mg/ml sobre C. albicans en un 99.4% además en las células se observan cambios en la morfológica de la pared celular (Figura 4C) y a la concentración de 0.371mg/ml se inhibió el 100% de la formación del tubo germinal y las células se observan lisadas (Figura 4D). El DMSO al 1.25% no tiene efecto en el cambio de la morfología de C. albicans. (Figura 4A y 4B)
Discusión.
Los aceites esenciales son extractos naturales de plantas y con actividades antimicrobianas, antisépticas, antiinflamatorias, antioxidantes y antifúngicas. Algunos de los aceites utilizados con potencial antifúngico son el de Mallaleuca alternifolia, Cymbopogon citratus, Cymbopogon martinii y algunos de sus componentes han sido probados in vitro sobre aislados clínicos de C. albicans que es un patógeno oportunista en el ser humano13.
En esta investigación se evaluó el efecto del aceite esencial de C. mexicana sobre aislados clínicos de C. albicans de vagina que se obtuvieron de mujeres con NICI y NICII, se demostró que tiene efecto fungicida en uno de los aislados clínicos y en la cepa ATCC, además tuvo efecto fungistático en cuatro de ellos. No obstante, en los aislados clínicos en los que no se observó disminución del crecimiento en las distintas concentraciones no significa que el aceite esencial no tiene efecto, si no que posiblemente se requiere aumentar la concentración de este en futuras investigaciones.
En el estudio de Nikolic et al. (2016) probaron el aceite esencial de plantas de la familia Burseaceae y se observó que el aceite esencial de Boswellia carteri mostró efecto fungicida sobre asilados clínicos de C. albicans de cavidad oral a concentraciones de 2.5mg/ml similares a las probadas en este estudio. Sin embargo, los aislados clínicos respondieron diferente a los tratamientos probados y pudiera relacionarse con mutaciones que presentan estos microorganismos. En este estudio observaron también que cepas ATCC son más susceptibles a los aceites esenciales en comparación que los aislados clínicos recuperados de garganta y boca14.
Para conocer en qué fase de crecimiento era más resistente la cepa ATCC al aceite esencial se realizaron ensayos en ambas fases de crecimiento (logarítmica y estacionaria). Se demostró que en fase logarítmica es menor la concentración del aceite de C. mexicana que se debe utilizar para el efecto fungicida en comparación con la fase estacionaria de crecimiento y se observó que en C. albicans el crecimiento en ensayos de 24h con el aceite se comporta de manera similar a los ensayos de fase estacionaria (3 horas).
Lo anterior coincide con lo reportado por Takeo (1985) en donde realizó ensayos en ambas fases de crecimiento de C. albicans para ver el efecto del antibiótico de polietileno filipin y observó que en la pared celular durante la fase logarítmica en interacción con el antibiótico está mostró numerosas protuberancias de aproximadamente 30nm de diámetro, además las membranas vacuolares presentaron deformación a diferencia de lo observado en fase estacionaria de crecimiento en donde C. albicans no mostró cambios apreciables en su pared celular15. Se ha demostrado que células en fase estacionaria de diferentes patógenos son más resistentes a diferentes tensiones incluido el estrés oxidativo16.
Se utilizó el acetato de linalilo el cual es uno de los principales compuestos del aceite esencial de C. mexicana de acuerdo a lo publicado por Cárdenas-Ortega et al. (2005) para ver si este compuesto tenía un efecto fungicida sobre C. albicans y se observó que para las tres condiciones de crecimiento utilizadas la concentración para tener un efecto fungicida fue la misma. Los resultados de esta investigación concuerdan con lo reportado por Blasko et al. (2017) donde probaron los principales compuestos mayoritarios de Salvia sclarea entre ellos el acetato de linalilo el cual utilizaron en ensayos de microdilución y encontraron la concentración mínima inhibitoria a dosis similares a las de este estudio17.
Además de tener un efecto fungicida el acetato de linalilo, Blasko et al. (2017) identificaron que este compuesto al ser utilizado sobre células de C. albicans retrasa 5h la entrada a fase logarítmica, por lo tanto, este efecto es similar a lo encontrado17. Sin embargo, se deben realizar más investigaciones para determinar cuál es el mecanismo de acción que tiene este compuesto sobre este microorganismo patógeno oportunista.
Las hifas son un factor importante en la invasión de tejidos del huésped, debido a la capacidad para adherirse a células epiteliales y endoteliales. Este crecimiento favorece la penetración en la célula o tejido ya que la formación de la hifa rompe las barreras tisulares gracias a que en su ápice se secretan enzimas capaces de degradar proteínas, lípidos y otros componentes celulares, esto facilita su infiltración en sustratos sólidos y tejidos18.
Por lo anterior, la inhibición de este mecanismo de virulencia se ha convertido en un blanco de interés para el uso de compuestos activos sobre C. albicans19. El aceite esencial de C. mexicana mostró tener efecto al inhibir el 100% el cambio de la morfología de levadura a hifa en la cepa Ca7, por lo tanto, al utilizarlo se disminuye la capacidad invasiva de este patógeno.
Este resultado es similar al reportado por Rocha et al. (2014) en donde el aceite esencial de Rosmarinus officinalis al 4% inhibió la formación de tubo germinal en aislados clínicos de C. albicans de cavidad oral, una posible explicación es que el estrés oxidativo ocasionado por los compuestos de los aceites esenciales afecta la actividad enzimática, así como el potencial de la membrana mitocondrial y da como resultado la inhibición del crecimiento y la muerte celular20. Este hallazgo es importante ya que el aceite esencial de C. mexicana pudiera tener una futura aplicación en el control y tratamiento de infecciones causadas por C. albicans.
Las infecciones por C. albicans en mujeres con diagnóstico de NIC pudieran ser más frecuentes debido el daño del epitelio cervical causado por el VPH, este crea un ambiente favorable para la proliferación e invasión de patógenos oportunistas como C. albicans. También influyen otros factores como la disbiosis vaginal que juega un papel importante en el microambiente vaginal. Algunos estudios mencionan que la microbiota cervicovaginal modula la respuesta inflamatoria del tracto genital femenino en mujeres sudafricanas21.
El efecto fungicida y fungistático del aceite de C. mexicana sobre C. albicans podría estar relacionado con alguno de los más de 30 compuestos del aceite esencial que se conocen, en donde los tres en mayor concentración son eucaliptol, piperitona y acetato de linalilo11. Si bien los mecanismos de acción de los aceites esenciales no están claramente descritos en levaduras y considerando la gran variedad de compuestos que contienen, es posible que su actividad antimicrobiana no sea atribuible a un mecanismo especifico, sino a la acción combinada de varios de ellos en distintas localizaciones de la célula22.
La acción antifúngica de aceites esenciales sobre C. albicans se ha visto que afecta la regulación y la función de importantes enzimas que catalizan la síntesis del número de componentes principales de polisacáridos de pared celular, como β-glucanos, quitina y manano, perturbando así el crecimiento celular y la morfogénesis.23
Bona et al. (2016) observaron a través de microscopia electrónica el daño ocasionando por aceites esenciales sobre C. albicans, utilizaron aceite esencial de orégano y el efecto que se vio fue en los orgánelos que se mostraban desorganizados. El núcleo tenía zonas condensadas y una membrana desorganizada, con aceite esencial de Satureja montana se encontró de igual manera desorganización de orgánelos y núcleo con cromatina no condensada, junto con la presencia de vacuolas autofágicas y en altas concentraciones indujo una disrupción total de los orgánelos celulares y finalmente las células se encogieron; además se originó una reducción significativa en el grosor de la pared celular, particularmente relacionada con la capa fibrilar.24
Los resultados de esta investigación demuestran la inhibición del crecimiento y cambio morfológico de C. albicans en presencia de aceite esencial de C. mexicana. En futuros estudios se puede indagar en el mecanismo de acción de este aceite, probar otros compuestos mayoritarios del aceite esencial, realizar microscopia electrónica para visualizar los cambios morfológicos que sufre este microorganismo y utilizarlo en otras especies como C. glabrata.
REFERENCIAS