Rev Med UAS
Vol. 10: No. 4. Octubre-Diciembre 2020
ISSN 2007-8013
Jose Antonio Ochoa-Retes1, Nora Selene Martínez-Félix2*, Felipe de Jesus Peraza-Garay3, Alma Rosa De la Mora-Fernández4.
*Correspondencia: Nora Selene Martínez-Félix
Eustaquio Buelna No. 91, Col. Gabriel Leyva, Culiacán, Sinaloa, CP: 80030.
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v10.n4.004
Recibido 13 de Junio 2020, aceptado 05 de Octubre 2020
RESUMEN
Objetivo: Determinar la frecuencia de ototoxicidad con el uso de aminoglucósidos en recién nacidos con diagnóstico de sepsis bacteriana temprana. --- Material y métodos: Estudio observacional, de prevalencia, descriptivo, prospectivo. Se incluyó todos aquellos recien nacidos (RN) hospitalizados en el área de neonatologia que se manejaron con esquema de antibiótico a base aminoglucósidos por haber presentado sepsis bacteriana y a los que posteriormente se les realzó emisiones otoacústicas (EO) para determinar la frecuencia de hipoacusia en el periodo que abarcó del 01 de enero al 31 de diciembre del 2018. --- Resultados. Se estudiaron 162 RN de los cuales se eliminaron 2 al no cumplir con los criterios de estudio. Se realizó EO y examinados por otorrinolaringología pediátrica. 18 estudios resultaron negativos (no pasaron la prueba de TA), en total se descartaron 10 en la segunda prueba y 8 se refirieron a potenciales evocados (PE). Finalmente el 100% se descarta hipoacusia o sordera. Se estudiaron variables secundarias; las de mayor impacto fueron manejo con ventilación mecánica y la prematurez; el 72.2% (IC95% 46.5, 90.3) fueron prematuros mientras que el 66.6% (41.0, 86.7) requirieron ventilacion mecanica del total de pacientes con alteraciones en la EO. --- conclusiones. La determinación de trastorno coclear y vestibular por medio de las EO es un método no invasivo, confiable, fácil de realizar. De acuerdo a nuestros resultados NO se presentó hipoacusia en esta población con ese factor de riesgo por sí solo, por lo cual no hay evidencia en contra del uso de aminoglucósidos en el RN. Se sugiere aumentar el número de pacientes prematuros temprano o extremos (menor de 32 SDG) por el impacto que presenta la prematurez para el desarrollo otoneurológico. Se recomienda continuar estudiando a los RN con FR para dar un una mejor atencion y mejorar la calidad neurosensorial del paciente pediatrico.
Palabras clave: Ototoxicidad, aminoglucósidos, sepsis neonatal.
ABSTRACT
Objective: To determine the frequency of ototoxicity with the use of aminoglycosides in newborns with a diagnosis of early bacterial sepsis. --- Material and methods: Observational, prevalence, descriptive, prospective study. All those newborns (NBs) hospitalized in the area of neonatology that were managed with aminoglycoside-based antibiotic scheme were included because they had presented bacterial sepsis and who subsequently underwent otoacoustic emissions (EO) to determine the frequency of hearing loss in the period from January 1 to December 31, 2018. --- Results: 162 RN were studied, of which 2 were eliminated because they did not meet the study criteria. EO was performed and examined by pediatric otolaryngology. 18 studies were negative (they did not pass the TA test), in total 10 were discarded in the second test and 8 referred to evoked potentials (PE). Finally, 100% rule out hearing loss or deafness. Secondary variables were studied; the ones with the greatest impact were mechanical ventilation and prematurity; 72.2% (95% CI 46.5, 90.3) were premature while 66.6% (41.0, 86.7) required mechanical ventilation of the total number of patients with abnormalities in the EO. --- Conclusions: The determination of cochlear and vestibular disorder by means of EOs is a non-invasive, reliable, easy to perform method. According to our results, there was NO hearing loss in this population with this risk factor alone, so there is no evidence against the use of aminoglycosides in the NB. It is suggested to increase the number of early or extreme premature patients (less than 32 SDG) due to the impact of prematurity on otoneurological development. It is recommended to continue studying the RN with FR to give better attention and improve the sensorineural quality of the pediatric patient.
Keywords: Ototoxicity, aminoglycosides, neonatal sepsis
Introducción
El uso de aminoglucósidos ha sido identificado como un factor de riesgo para el desarrollo de ototoxicidad en la población neonatal, dichos antibióticos son usados comúnmente en monoterapia o combinados en este grupo etario para el tratamiento de la sepsis neonatal.
La OMS contempla a los aminoglucósidos como medicamentos ototóxicos que pueden llegar a causar sordera, establece además que 5 de cada 1000 Recien Nacido (RN) nacen con una pérdida de audición o la sufren en la primera infancia1.
El descubrimiento de los antibióticos derivados de los aminoglucósidos se realizaron desde los años 40´, Waskman y colaboradores fueron los primeros investigadores que aislaron cepas microbianas (Streptomyces griceus) desarrollaron el primer aminoglucósido llamado Estreptomicina. En el año 1972 sale al mercado otro antimicrobiano tobramicina y la Amikacina (derivado semisintético de la Kanamicina) que al igual que la Gentamicina son los más usados como el primer esquema de tratamiento para sepsis en el RN2.
Son antimicrobianos que a mayor concentración mayor rapidez es su actividad bactericida, su mecanismo de acción exacto es penetrando la membrana bacteriana difundiéndose por medio de canales acuosos formados por porinas, proteínas que se encuentran en la membrana externa de las bacterias gramnegativas y penetran el espacio periplasmático uniéndose a los ribosomas 30s y 50s inhibiendo la síntesis proteicas.2 Las concentraciones de estos fármacos en secreciones y tejidos son pequeñas, solamente se encuentran en concentraciones máximas en corteza renal así como endolinfa y perilinfa del oído interno, con el riesgo de nefrotoxicidad y ototoxicidad.2
Rodríguez y cols. En el 2010 publican en una revisión del efecto antitóxico de amino glucósidos refiriendo el mecanismo por el cual producen daño de las células ciliadas de la cóclea (CC) situadas en el órgano de Corti (OC) y degeneración retrograda de las neuronas del ganglio espiral lo cual ocasiona sordera neurosensorial por formación de especies reactivas de oxígeno por la liberación de los niveles de óxido nítrico y los radicales peroxinitrilo3.
Según Taketomo, refiere farmacocinética de la vida media de amikacina en RN con peso bajo al nacer en los primeros 3 días de vida de 7 horas y en RNT mayores de 7 días de vida con vida media más corta de 4 a 5 horas. Mientras que el tiempo en alcanzar las concentraciones séricas máxima es por vía intramuscular es de 45 a 120 minutos y por vía intravenosa es de 30 minutos después de la infusión.4
Labueane en el 2001, Allegaert en el 2008 y Sherwin en el 2009 establecen que la dosis en el RN debe de basarse de acuerdo a la edad posmenstrual5. Thomas E. en su bibliografía en el manual Neofax 12va. Edición, los indican por edad gestacional e intervalos de horas: Menor de 29 de gestación 15mg/k/dosis cada 48 horas. De 30 a 33 semanas de edad gestacional de 14 mg/k/dosis cada 48 horas y RN de 34 a 37 SDG la dosis la indica de 12mg/k/dosis cada 36 horas y en mayores de 38 SDG es la misma dosis pero con intervalos de cada 24horas6.
Croos y cols en el 2015 publican en el Journal of pediatrics que los marcadores inflamatorios aumentan la captación de aminoglocósidos en la cóclea ocasionando mayor ototoxicidad y pérdida sensorial de células ciliadas7.
En el año 2015 Mackinney y cols realizaron un estudio en ratas para observar la ototoxicidad a la exposición de aminoglucósidos tomando en cuenta la cronofarmacocinética (tiempo de administración dependiente; basado en la absorción, distribución y eliminación) Usando la respuesta auditiva del tallo cerebral (ABR) con mediciones en intervalos de 2 semanas en el periodo del descanso diurno o nocturno libre de administración del medicamento, en diferentes grupos de ratas que se administró kanamicina y gentamicina con una duración de 6 semanas, mostrando una mayor pérdida de la audición para los grupos diurnos.8
Para el 2013 en los estados unidos (EE. UU), de 4 millones de nacimientos, el 12% ingresan a las salas de cuidados intensivos neonatales (UCIN) y de estos el 2 a 4 % presentan una incidencia de pérdida de audición al ser egresados del hospital por el uso de AG.9
En el mismo año España reporta una incidencia del 7.69% de hipoacusia en la población de riesgo, lo cual supone un 2.8 casos por cada 1000 nacidos vivos según la publicación del 2013 de Robles y Cols ante un estudio en atención infantil temprana en este grupo de niños con potenciales riesgos10.
La incidencia de hipoacusia en la población en general, según el Instituto Nacional de Estadística y Geografía basado en el Censo de Población y Vivienda del 2010, el 12.1% de la población con discapacidad tiene problemas auditivos y en el 2012 la Subsecretaria de Prevención y Promoción de la Salud (SPPS) reportó una prevalencia de hipoacusia pediátrica de 1.4 en cada 1000 nacimientos.11
En el año 2009 la secretaria de salud publico el programa de acción específico para la realización del tamiz auditivo con el objetivo de promover la detección oportuna de hipoacusia y sordera en el RN con o sin factores de riesgo, y en el 2011 el senado de la república aprobó una reforma a la ley general de salud en estudiar de manera obligatoria la prueba de tamiz auditivo.12
Lino y Cols en el 2015 postulan la realización del tamiz auditivo neonatal para todos los RN y con ello permitir la identificación temprana de problemas de audición y su tratamiento, de tal manera que por protocolos y guías de manejo internacionales de estas complicaciones sea lo más temprano posible a no más de un año de edad alcanzada en el lactante con la finalidad de mejorar las condiciones de neurodesarrollo.13
Se ha demostrado en diversos estudios que la hipoacusia durante los primeros 6 meses de vida interfiere con un desarrollo normal del habla y el lenguaje oral. Es por esta razón la importancia del diagnóstico antes de los 3 meses de edad y comenzar un tratamiento dentro de los primeros 6 meses de vida14.
En países desarrollados, en el año 1993 la Asociación Mexicana de Pediatría (AMP) implementó la realización de manera universal el tamiz auditivo neonatal y fue actualizado en el 2010 junto con la American Development Conference on Neonatal Hearing Screening, y la CODEPEH (Comisión para la detección precoz de la hipoacusia infantil) para que se llevara a cabo antes del primer mes de vida y máximo a los 3 meses, para que el manejo sea antes de los 6 meses de edad con la finalidad de mejorar el neurodesarrollo en el primer año de vida15
En el 2018 Nermic Hrncic y Cols, estudiaron RN con factores de riesgo asociados para presentar hipoacusia en un Hospital Materno Infantil de un Hospital de Bosnia encontrando que dentro los factores de riesgo para presentar este tipo de complicación: el uso de aminoglucósidos por 5 días alcanzo hasta 4 veces más riesgo de presentar parálisis auditiva así mismo se tomó en cuenta otros factores de riesgo como lo son la prematurez, asfixia, hiperbilirrubinemia y puntajes bajos se Apgar16.
Respecto a los RN con factores de riesgo para trastorno auditivo el JCIH (conjunto de Audición Infantil) recomienda que además de la realización de EO deben de ser evaluados tecnología capaz de detectar la neuropatía o hipoacusia mediante la medición automatizada de respuesta auditiva del tallo cerebral (ABR)17.
En una encuesta realizada a médicos neonatólogos, pediatras y residentes sobre factores de riesgo, diagnóstico precoz y rehabilitación de RN con alto riesgo de presentar discapacidad auditiva se observó falta de conocimiento además de una falta de trabajo en conjunto con el especialista en materia de Otoneurología para compartir información18.
En México que es un país en vías de desarrollo la secretaria de salud pública en las guías de práctica cínica e hipoacusia neurosensorial bilateral e implantación coclear (guías del CENETEC) inicia a los 3 meses los estimuladores auditivos en aquellos niños que por seguimiento pediátrico no pasan las pruebas otacústicas así como potenciales evocados a un máximo de 3 repeticiones siendo alrededor de los 3 años 6 meses el objetivo de iniciar con estimuladores otacústicos y ofrecer cirugía de ser necesario el implante coclear antes del año de edad sin embargo debido a tipo de población con el que se cuenta este objetivo aún no se alcanza de manera adecuada.19
El protocolo de screening auditivo neonatal recomendado por la CODEPEH (Comisión para la Detección de la Hipoacusia Infantil) asociación española según Faustisno y Cols. En el 2017 consta de tres fases: 1.ª fase al nacimiento o antes del alta hospitalaria siendo el criterio de paso la obtención de onda V con PEATC-A a 40 dB de estimulación o la obtención de emisiones otoacústicas evocadas (OEA) bilaterales, 2.ª fase: los niños que no superan la primera son evaluados nuevamente a los 3 meses de edad y la 3.ª fase, en la que los niños que no superan tampoco la segunda exploración son evaluados por los ORL(otorrinolaringólogo) para el diagnóstico y tratamiento definitivos antes del sexto mes de vida. 20
En México coincidimos en la clasificación diseñada por la Asociación Española de Pediatria (AEPED), por ser la más aceptada para discapacidad auditiva en el paciente pediátrico
Las EO fueron descritas en el año 1978 por David Keem “se realizan por medio de un dispositivo portátil, introduciéndose una pequeña sonda en el conducto auditivo externo la cual emite sonidos de intensidad baja a lo cual la cóclea responde con una emisión otoacústica catalogado como un “eco” que pasa de vuelta al oído medio al conducto auditivo y de esta manera es analizado por el dispositivo. El resultado se reporta como “Pass” (Pasa) o “refer” (Remitir) aproximadamente 30 segundos después.21
Material y métodos:
Se realizó una encuesta descriptiva. Estudio de prevalencia.
Se incluyó todos aquellos RN en el área de neonatologia que se manejaron con esquema de antibiótico a base aminoglucósidos por haber presentado sepsis bacteriana del recién nacido y a los cuales al egreso hospitalario se les realizó emisiones otoacústicas en el periodo que abarcaró de enero del 2018 a diciembre del 2018 en Hospital Civil De Culiacán en el área de neonatología y área de consulta de medicina preventiva de dicho hospital.
Se incluyeron recién nacidos de ambos sexos, hijos de madre de cualquier edad materna (16 a 40 años). Neonatos (periodo de 1 día a 28 días de vida).Todas las edades gestacionales. Puntaje de APGAR al nacimiento.
Requirieron o no de ventilación mecánica. Realización de emisiones otacústicas (1ª antes del mes de vida y 2da al mes de vida).
El análisis estadístico: Los datos categóricos se describieron con frecuencias y porcentajes. Se calcularon intervalos de confianza del 95% para la frecuencia de otoxocidad.
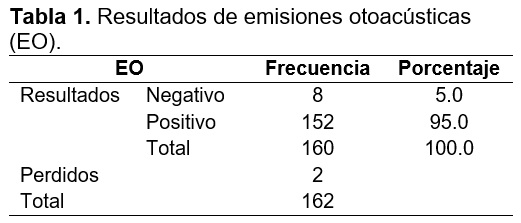
Se recolectó un total de 162 pacientes (100%) con antecedentes de hospitalización al nacer en este nosocomio y manejado con aminoglucósidos, de los cuales se eliminaron 2; uno por presentar malformación anatómica y otro no acudió al seguimiento del protocolo. Al resto se les realizó emisiones otoacústicas según el seguimiento y fueron examinados por otorrinolaringología pediátrica, el periodo de recolección abarcó del 01 de enero al 31 de diciembre del 2018.
Del total de los pacientes (160), 18 no pasaron las emisiones otoacústicas durante su seguimiento; de ellos 8 (5%) pacientes al final se enviaron a potenciales evocados por persistir con tamiz auditivo negativo. (Tabla 1).

De los 18 pacientes que resultaron negativo (que no pasaron la prueba del tamiz auditivo) durante las 2 pruebas realizadas, solo 8 de ellos resultaron negativos por lo que se enviaron a realizar la prueba de potenciales evocados y ninguno resulto positivo para hipoacusia o sordera (tabla 2).

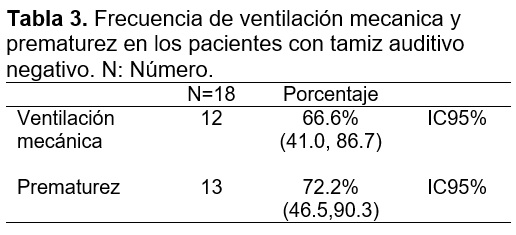
Se estudiaron variables secundarias entre ellas de las más importantes es el manejo con ventilación mecánica durante su hospitalización y la edad gestacional. Entre los resultados de estas variables se encontró que de los pacientes que presentaron alteraciones en las emisiones otoacústicas el 72.2% (IC95% 46.5, 90.3) fueron prematuros mientras que el 66.6% (41.0, 86.7) requirieron ventilacion mecanica. Tabla 3 y 4.

El tamaño de muestra en general fueron 104 masculinos (64.2%) y 58 femeninos (35.8%) y del total de los 8 pacientes que requirieron potenciales evocados el 50% fueron masculinos y el otro 50% femenino por lo que no hubo diferencia significativa en el sexo.
Del total de los 162 pacientes que se estudiaron la mayoría ellos; 124 (76.5%) tuvieron manejo de aminoglucósido con un esquema de 7 días (tabla 5)
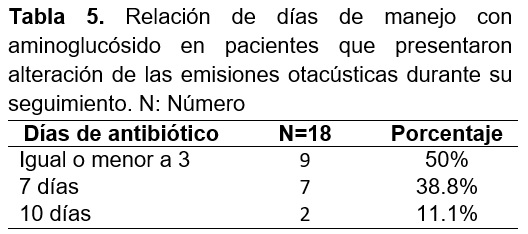
En esa tabla se observa que no hay una relación directa con los días de manejo con aminoglucósido en nuestra población de estudio que reportaron tamiz auditivo negativo.
Discusión.
Los factores de riesgo para la discapacidad auditiva en nuestro estudio se basaron únicamente en el uso de aminoglucósidos 100% de los pacientes mediante la realización de emisiones otoacústicas.
La hipoacusia diagnosticada en tempranas edades de la pediatría se ha venido presentando desde que se implementó el tamizaje auditivo mediante la detección y seguimiento temprano en la etapa neonatal por medio de pruebas de audición como lo son las emisiones otoacústicas o tamiz audiológico enfocadas principalmente a detectar hipoacusia neurosensorial; coadyuvando a dar un manejo temprano y mejorar el pronóstico de neurodesarrollo en la primera etapa del lactante. Para lograr este objetivo se realiza de manera obligada antes del mes de vida con o sin factores de riesgo para presentarla como lo marca la norma 22.
En base a la literatura se sabe que uno de los factores de riesgo de sordera puede ser el uso de antibióticoterapia a base de aminoglucósidos por sus efectos adversos a nivel coclear y vestibular, es por ello que se han modificado la frecuencia de intervalos de dosis de aplicación en los neonatos, siendo esta la población más vulnerable para presentarla debido a su inmadurez otoneurológica. En casi el 100% de todos los RN prematuro, sobre todo en aquellos de edades gestacionales menor de 32 semanas son manejados en algún momento de su estancia hospitalaria con aminoglucósidos como tratamiento de primera linea profiláctico o terapéutico para sepsis temprana. En este nosocomio contamos con una incidencia de sepsis neonatal temprana en los últimos 3 años del 3.7% del total de los nacimientos; sin embargo alrededor del 50.24% de los RN hospitalizados son manejados con aminoglucósidos como primera línea de tratamiento para el manejo de sepsis neonatal temprana.
No existen reportes de estudios a nivel nacional ni estatal donde se documente la frecuencia de hipoacusia aunada al uso de aminoglucósidos exclusivamente en pacientes hospitalizados mediante un protocolo de estudio con seguimiento desde la etapa neonatal. Este estudio se realizó con el objetivo de determinarla y estudiar los factores asociados que se presenten entre el mimo grupo de pacientes.
Cabe señalar que el tamiz auditivo no está indicado de preferencia en los primeros días de vida debido a la alta incidencia de falsos negativos por la poca confiablidad que presenta a la inmadurez coclear y falta de reabsorción de líquido a este nivel, es por ello que los resultados son más confiables alrededor de la 2 a 3 semana de vida. Así mismo la ley general de salud recomienda realizar el tamiz auditivo al cumplir una semana de haber terminado el esquema antimicrobiano. 22
Este estudio abarco 162 pacientes a los que se le realizaron emisiones otoacústicas; el 11% que resulto con tamiz auditivo negativo el 44% de ellos se les realizo potenciales evocados (estándar de oro para corroborar el diagnostico de hipoacusia) reportando negativo para sordera. La frecuencia de hipoacusia con el uso de aminoglucósidos en el servicio de neonatologia de este hospital en pacientes hospitalizados no presento riesgo para sordera. Los resultados fueron una frecuencia del 5% quienes no pasaron las EO, con un IC 95% (2.2-9.6%) con un RR (0.021,0.09) lo cual es estadísticamente similar a lo que establecen algunas literaturas como lo plasmado en el artículo de Nermin Hrnčić 16 y Poonual W y Cols23, este estudio se incluyó otros factores de riesgo además del uso de aminoglucósidos, la prematurez, días de tratamiento con antibiótico, puntuación de APGAR, sexo y manejo ventilatorio asociado a alteraciones en los resultados de las EO.
Las variables con mayor impacto observadas fueron edad gestacional y el manejo ventilatorio. Lo que se observo es que el 72% de los pacientes que se les dio seguimiento a potenciales evocados fueron prematuros y 67% requirieron ventilacion mecanica. En cuanto a los días de manejo con aminoglucósidos no hubo una relación significativa ya que a pesar de que el 76% mantuvieron el manejo durante 7 días y los pacientes que resultaron con EO negativos el 50% tuvo un esquema de 3 días por lo que se corrobora que el número de días de manejo no tuvo relevancia en cuanto a los resultados.
Conclusión.
La pérdida auditiva en México según el reporte de la Subsecretaria de Prevención y Promoción a la Salud en el 2012 (SPPS) reportan una frecuencia 1.4 por cada 1000 pacientes pediátricos refiriéndose a hipoacusia de múltiples causas12, afectando el aprendizaje en la infancia.
La determinación de trastorno coclear y vestibular por medio de las emisiones otoacústicas resulta ser un método no invasivo, confiable, fácil de realizar y el cual se lleva a práctica en nuestro hospital.
Se encontró poca literatura que hablen sobre hipoacusia en el recién nacido por aplicación de aminoglucósidos en nuestro país comparado con otros, en nuestro hospital según nuestros resultados NO se presentó hipoacusia en esta población con ese factor de riesgo por sí solo, por lo cual no hay evidencia en contra del uso de aminoglucósidos, sin embargo se necesitaría aumentar el número de pacientes prematuros temprano o extremos (menor de 32 SDG) debido al impacto que presenta la prematurez para el desenlace de desarrollo otoneurológico. Coincidimos con otros autores (Janssen T y Cosl24) en la efectividad de las emisiones otoacústicas para el tamizaje de alteraciones otológicas, con factores de riesgo.
Además con esta investigación en nuestro hospital se logró implementar un seguimiento más dirigido y exhaustivo en el cual se incluye la exploración por otorrinolaringología pediátrica en tiempo y forma según la edad del lactante y aplicación del flujograma expuesto en el apartado correspondiente para con ello implementar medidas necesarias con la finalidad de captar a la población de mayor riesgo y más vulnerable con el objetivo de dar un diagnóstico y manejo temprano y mejorar la calidad neurosensorial desde los 6 meses de edad con manejo de estimulación otoacústica vs implante coclear desde el primer año de vida que es lo ideal según la literatura y trabajos realizados en otras partes del mundo.
Referencias