Rev Med UAS; Vol. 9: No. 1. Enero-Marzo 2019
ISSN 2007-8013
Reyes Hansen Milly Diorey1*, Villanueva Herrero Juan Antonio2, Jiménez Bobadilla Billy3.
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v9.n1.004
*Correspondencia: Dra. Milly Diorey Reyes Hansen. Hospital General De México “Dr. Eduardo Liceaga”.
Departamento: Servicio de Coloproctología. Unidad 310 I. Dirección: Dr. Balmis 148, Doctores, 06720 Ciudad de México.
Correo: millyrh@hotmail.com
Recibido 10 Agosto 2018, aceptado 23 Enero 2019
RESUMEN
Objetivo. Identificar la eficacia del ultrasonido endorrectal posterior a neoadyuvancia (USE PN) para determinar la respuesta patológica completa (RPC) en pacientes con cáncer de recto medio e inferior sin estenosis. Material y métodos: Serie de casos; pacientes del servicio de Coloproctología del Hospital General de México “Dr. Eduardo Liceaga” con diagnóstico de cáncer de recto medio e inferior, evaluados por USE Pre y posterior a la neoadyuvancia entre 1 enero 2016 al 30 de diciembre 2017. Excluyeron tumores estenosantes y/o dolor anal. Todos recibieron neoadyuvancia con capecitabine y 49.5 Grys de radioterapia. Se realizó el USE PN a las 9 semanas. Se analizaron las siguientes variables: estadio T y N, longitud y volumen previo y posterior a la neoadyuvancia, porcentaje de regresión de longitud, volumen y distancia del tumor al esfínter anal. Se tomaron medidas de tendencia central y porcentajes. Resultados: Se incluyeron 6 pacientes con edad media de 61 años, 4 mujeres y 2 hombres. Previo a la neoadyuvancia el 50% presentaba un uT4, el 50%, un uT3. El 33% se identificó ganglios por USE. Posterior a la neoadyuvancia la concordancia del USE PN en comparación con la pieza de patología en la identificación de penetración tumoral (T) fue del 83% y para ganglios el 66%. El porcentaje de regresión tumoral en longitud fue 28.5 % y de 65% en volumen. Ninguno de los pacientes presentó RPC. Conclusiones: El USE tiene una buena eficacia para calcular el porcentaje de regresión con respuesta clínica y patología parcial en el 100% de nuestros pacientes.
Palabras clave: Neoplasia de recto, ultrasonido, neoadyuvancia, incontinencia, resonancia magnética.
ABSTRACT
Objective: To identify the efficacy of post-neoadjuvant endorrectal ultrasound (EUS PN) to determine the complete pathological response (CPR) in patients with middle and lower rectal cancer without stenosis. Material and methods: Original article, clinical study; patients of the Coloproctology service of the General Hospital of Mexico "Dr. Eduardo Liceaga "with diagnosis of cancer of the middle and lower rectum, evaluated by Endorrectal ultrasound Pre and post-neoadjuvant between January 1, 2016 and December 30, 2017. Excluded stenosing tumors and / or anal pain. All received neoadjuvant with capecitabine and 49.5 Grys of radiotherapy. PN USE was performed at 9 weeks. The following variables were analyzed: stage T and N, length and volume before and after neoadjuvant, percentage of regression of length, volume and distance of the tumor to the anal sphincter. Measures of central tendency and percentages were taken. Results: Six patients with a mean age of 61 years, 4 women and 2 men were included. Prior to neoadjuvant, 50% had a uT4, 50%, a uT3. 33% were identified nodes by EUS. After neoadjuvant, the agreement of the EUS PN compared with the piece of pathology in the identification of tumor penetration (T) was 83% and for lymph nodes 66%. The percentage of tumor regression in length was 28.5% and 65% in volume. None of the patients presented CPR. Conclusions: EUS has a good efficacy to calculate the percentage of regression with clinical response and partial pathology in 100% of our patients.
Keywords: Rectal cancer, ultrasound, neoadjuvance, incontinence, magnetic resonance.
INTRODUCCIÓN
El cáncer de colon y recto representa el cuarto lugar en frecuencia y segundo de muerte en los Estados Unidos de América.
En el 2016 se presentaron 39,222 casos nuevos, por genero 2:1 masculino y femenino. En México la incidencia por 100,000 habitantes se registra 7.76 habitantes según últimas estadísticas en el 2013. La incidencia del cáncer ha disminuido en un rango aproximado del 3% por año entre el 2003 y 2012.1 La mortalidad ha disminuido casi hasta el 35% de 1990 a 2007.2 Esto como consecuencia de la prevención y diagnóstico temprano, así como la detección oportuna y mejoras en las modalidades del tratamiento.
A pesar de las mejoras observadas, en estudios prospectivos como el SEER CRC encuentra un aumento en la incidencia en población menor de 50 años.3 Incidencia del cáncer rectal incrementará hasta un 124.2% en pacientes entre 20 y 34 años para el 2030. Esta causa en esta tendencia aun es desconocida.
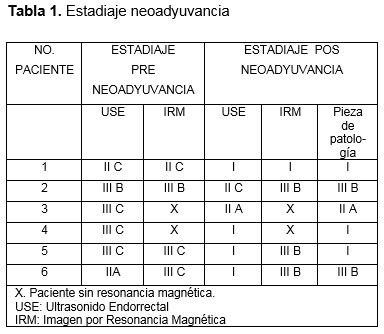
Dentro del abordaje del cáncer rectal se incluyen una serie de estudios para tener un estadio y decidir un manejo; neoadyuvante, paliativo o quirúrgico y estimar una sobrevida. Este protocolo incluye de manera sistemática: biopsia positiva a malignidad, colonoscopia, tomografía toracoabdominopelvica contrastada, Antígeno carcinoembrionario, resonancia magnética de pelvis contrastada o el ultrasonido endorrectal 3D (USE 3D), obteniendo así un estadio basado en el TNM; por sus siglas tumor, nódulos y metástasis.4 Recordando que el antígeno carcinoembrionario es un estudio de seguimiento en cáncer de recto y no de estadiaje, así como el PET-CT un estudio de imagen solicitado ante la sospecha de recidiva de cáncer no identificada con estudios convencionales.4 Ver Tabla 1.
El ultrasonido endorrectal 3D nos da con exactitud información del tamaño del tumor y la relación con los músculos anorrectales y desde 1992 hasta la fecha se ha estudiado ampliamente para la estadificación inicial y posterior a la neoadyuvancia.5

Existe una curva de aprendizaje de más de 50 estudios endorrectales deben ser realizados para tener una efectividad en la interpretación en cuanto a la profundidad del tumor y la efectividad en la búsqueda de ganglios mesorrectales aumenta entre 50-77% después de realizar 30 USE 3D.6
No existe una técnica única para realizar el ultrasonido endorrectal; debido a la preferencia de cada institución; la universidad de Harvard, explica la necesidad de la siguiente preparación con enemas de fosfato de sodio 1-3 horas previo al estudio para una limpieza de las paredes anorrectales, debido a que la materia fecal crea una interfase y artefacto entre la mucosa y el transductor. Puede realizarse en decúbito lateral izquierdo o en navaja sevillana la cual proporciona una simetría en el canal anal sobre todo, debe configurarse una distancia focal desde 2 cms (centímetros) para visualizar las paredes rectales hasta 5-6 cms en la región mesorrectal y valorar ganglios. El transductor es montado en una camisa de metal de 24 cms con la cual se verifica que debe sobrepasar el tumor rectal por completo. La preparación del transductor para una buena examinación es importante debe ser insuflado un globo con agua entre 40-60ml para formar una interfase cuando ya es introducido en el recto y ser factible el contacto del transductor con las paredes del recto y tumor. No necesariamente debe ser introducido los 24 cms de la camisa metálica con 10-12 cms es suficiente llegando a la unión recto sigmoidea. Las lesiones deben ser descritas de la siguiente manera: tamaño, profundidad, invasión en las capas de la pared, grado de involucro circunferencial, localización (anterior- posterior-derecho o izquierda), la presencia o ausencia y tamaño de ganglios linfáticos perirectales.6
USE 3D es factible realizarse en tumores de tercio medio e inferior no estenosantes; la invasión del tumor en las capas del recto se evalúan según el estadio propuesto por Hildebrandt y feifel desde 1985.7,8 La evaluación de los ganglios en el mesorrecto por ultrasonido se reportan como presentes o ausentes, sin importar el número, tomando como positivos las siguientes características: ecogenicidad similar a la del tumor y tamaño mayor de 1 cm.9,10 Otros autores toman en cuanto ganglios positivos a partir de 5mm con características de ecogenicidad mixta, márgenes irregulares, forma ovoide o plana.11
Otras clasificaciones como la propuesta por Wong la cual no solo toma la invasión del tumor en las capas del recto sino también la afección en el mesorrecto. Reportando misma eficacia en el estadiaje que la resonancia magnética teniendo la ventaja que el USE 3D es factible realizarse en el consultorio a menor costo.12 Reporte de eficacia en el estadiaje de la invasión del tumor (T) 68.6% para USE 3D mediante la clasificación de Wong vs 72.9% para Resonancia magnética, sin tener significancia estadística.13
En general la efectividad en el uso del USE 3D para la detección de la profundidad en la invasión de tumor en las paredes del recto previo a la neoadyuvancia es decir el ultrasonido inicial del protocolo de estadificación se reporta entre 69%-94%. Para distinguir entre lesiones tempranas y avanzadas tiene una sensibilidad, especificidad y efectividad en rangos de 96%, 85% y 94% respectivamente. Y en el detección de ganglios linfáticos eficacia del 64%-83%.14
La terapia neoadyuvante es decir quimioterapia y radioterapia preoperatoria es el estándar de oro en el manejo del cáncer rectal localmente avanzado.15 Evaluación de la profundidad de invasión (T) y la afectación de ganglios linfáticos (N) son componentes vitales de la estadificación preoperatoria.16
Uno de los términos más estudiados es la respuesta al tratamiento neoadyuvante en el cáncer de recto. Recientemente las guías de CAP (protocolo de examinación de piezas de patología17 reportan que se deberá tener un reporte de patología para definirlo. La respuesta debe ser graduada como 0 (respuesta completa- sin células malignas presentes) hasta 3 (pobre respuesta o cáncer residual extenso).
El reestadiaje o también llamado evaluación de la respuesta al tratamiento después de la neoadyuvancia se realiza para planificar un abordaje quirúrgico definitivo. La resonancia magnética, tomografía computada y ultrasonido endorrectal son modalidades utilizadas; pero la precisión de estas técnicas para determinar la fase T y a la afectación ganglionar es limitada.18 También el PET FDG (Tomografía de emisión de positrones fluordeoxiglucosa) está siendo investigado por su capacidad para determinar con precisión la respuesta al tratamiento neoadyuvante.19
En general se tiene reportando una evidencia de respuesta patológica completa entre 8-25% después de la neoadyuvancia, siendo posible evitar cirugías respectivas extensas con alto índice de morbilidad.20
Uno de los primeros estudios en 1999 que correlaciona el uso del USE 3D posterior a quimioterapia y radioterapia en la evaluación de la respuesta patológica; se encontró que no tenían una eficacia favorable en el reestadiaje a las 6 semanas; ya que solo el 50% de los pacientes estaban correctamente evaluados, comparándolo con la pieza de patología, sin embargo se hace énfasis en el estudios continuo, adiestramiento y más estudios para determinar una adecuada interpretación.21
La aplicación del USE 3D en la evaluación de la respuesta clínica posterior a la quimio y radioterapia aun es estudiada debido a la inflamación, necrosis y fibrosis que la misma terapia neoadyuvante ocasiona. Estudios prospectivos evalúan el uso secuencial del USE 3D en el cáncer rectal localmente avanzado (estadios II /III). Encontrando correlación entre la tasa de regresión tumoral en los pacientes que se realiza el USE 3 D después de las 8 semanas haber terminado la neoadyuvancia.22
En el 2011 se publica en Brasil criterios ultrasonográficos para evaluar la respuesta entre 50-55 días posterior a la neoadyuvancia clasificando respuesta completa (regresión total del tumor), parcial (disminución del tumor en > de 20% de la longitud y volumen) o insignificante (disminución < 20% del tamaño tumoral), esto mediante un ultrasonido endorrectal 3 D (USE).23 Este estudio se comparó con el estándar de oro que es el reporte de patológica; Concluyendo que el USE evalúa con precisión la respuesta a quimioradioterapia, ayudando en la selección de pacientes para una resección preservadora de esfínteres.
Existen metaanálisis donde se evalúa la habilidad del USE posterior a la neoadyuvancia en la detección de la invasión local o en la invasión de los márgenes circunferenciales solo en 10 estudios valorables; teniendo una sensibilidad del 69% (IC 95%, 45%-86%); especificidad del 96% (IC 95%, 91%.98%) VPP 61% (IC 95%, 35%-82%), VPN 97% (IC95%, 95%-98%), exactitud del 94% (IC 95%, 92%-96%); sin embargo son estudios muy heterogéneos, pero con valores muy similares a la resonancia magnética.18 En cuanto a la respuesta de ganglios posterior a la neoadyuvancia solo 16 estudios encontrados hasta el 2015 con una sensibilidad del 53%, especificidad del 80%, VPP 55%, VPN 79% y exactitud del 72%.18
Debido al auge del ultrasonido endorrectal 3D se ha comparado con la resonancia magnética encontrando similar eficacia en la estadificación del tumor y ganglios linfáticos. Teniendo en cuanta que el ultrasonido es superior en las visualizaciones de lesiones T1 (confinados a la mucosa) y sin tener diferencia estadística para tumores que sobrepasan la muscularis propia. Ante la presencia de ganglios perirrectales la resonancia magnética tiene una eficacia del 79% vs USE 3D 65% sin embargo sin diferencia estadística. 24
Por último otras tendencias afirman que el uso del USE 3D y la IRM (Imagen por Resonancia Magnética) son necesarias para una evaluación posterior a la neoadyuvancia y previo a la cirugía.25
Se tiene otros recursos pero para el seguimiento pero no para estadiaje del paciente con cáncer de recto como es el Antígeno Carcinoembionario.
MATERIAL Y METODOS
Estudio de serie de casos en la cual se incluyeron a los pacientes del servicio de Coloproctología del Hospital General de México “Dr. Eduardo Liceaga” con diagnóstico de cáncer de recto no estenosante, evaluado por USE endorrectal pre y posneoadyuvancia. Se incluyeron pacientes con cáncer de recto medio e inferior del 1 enero 2016 al 30 de diciembre del 2017.
Se excluyeron aquellos con tumores estenosantes y/o dolor anal a la exploración. Todos los pacientes recibieron neoadyuvancia con capecitabine y 49.5 Grys de radioterapia. Se realizó el Ultrasonido endorrectal posneoadyuvancia 9 semanas posteriores a finalizar la misma.
Se utilizó el equipo BK Medical Flex Focus 400 US Scanner 1202 con transductor 2052, revisando el resguardo de imágenes para las mediciones necesarias de los ultrasonidos pre y pos neoadyuvancia. Posterior se toman los datos del sistema electrónico de la pieza de patología para analizar los datos al final de nuestra recopilación de muestra retrospectiva. Las mediciones solo se realizan por una sola persona, misma capacitada 1 año en ultrasonido endorrectal por esta misma institución.
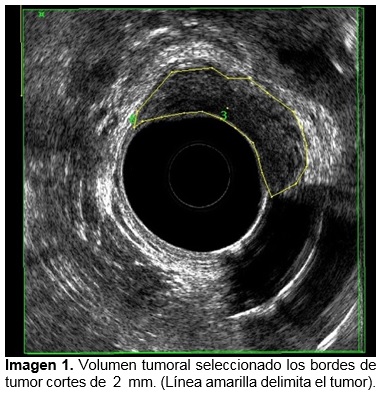
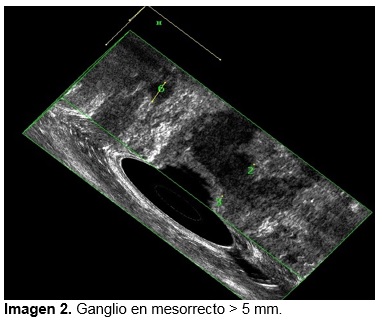
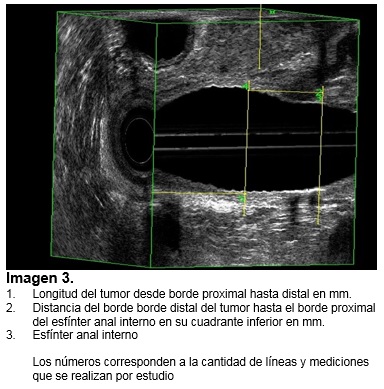
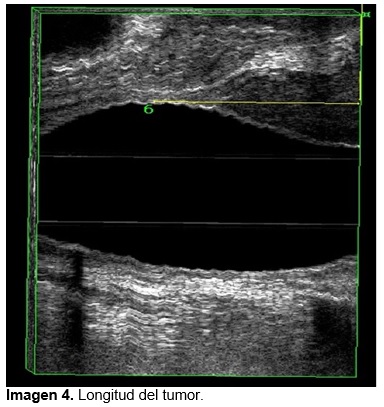
Se analizaron las siguientes variables mediante sistema SPSS (v. 23.0): estadio T y N previo a la neoadyuvancia y posterior a la quimioradioterapia, longitud y volumen del tumor antes y después de la quimioradioterapia, porcentaje de regresión de longitud y volumen y distancia del tumor al esfínter anal interno en su cuadrante inferior antes y después de la quimioradioterapia. (Ver imagen de 1-5). Se tomaron medidas de tendencia central y porcentajes de acuerdo al tipo de variable.
No se solicitó fuentes de financiamiento para este estudio, ya que el servicio de coloproctología cuenta con el Ultrasonido endorrectal: Equipo BK Medical Flex Focus 400 US Scanner 1202 con transductor 2052, resonancia magnética del Hospital General de México, expedientes clínicos de la clínica de cáncer de recto y al tratarse de un estudio retrospectivo; el paciente financió por sus propios medios dichos estudios para finalizar su protocolo de estudio.
Relevancia y expectativas
La relevancia de nuestra investigación a nivel internacional radica en la ausencia del reporte de la eficacia de la utilización del ultrasonido endorrectal posterior a la neoadyuvancia en el cáncer de recto, este recurso disponible solo en dos sedes de la República Mexicana, sin ningún reporte del mismo. A nivel mundial quien más tiene publicado sobre el tema Doctora M. Regadas en Brasil, juntando en su serie 55 pacientes con ultrasonido endorrectal en posneoadyuvancia. Se espera tener una muestra menor en nuestra institución tomando en cuenta que se diagnostican 50 paciente con cáncer de rectal al año aproximadamente.
RESULTADOS
De enero 2016 a diciembre 2017, se atendieron a 94 pacientes diagnosticados con cáncer de recto de tercio medio y de tercio inferior; mismo que completaron protocolo de etapificiación, para recibir neoadyuvancia o paliación. 46 casos no se les realizó USE por estenosis tumoral > 80 % de la luz anorrectal.
Solo 6 pacientes fueron evaluados previo y posterior a la neoadyuvancia con ultrasonido endorrectal. 4 pacientes contaban además con IRM. 66% género femenino, edad media de 61 años. Ver tabla 1.
Los tumores medidos por rectosigmoidoscopía rígida tenían un borde distal de 5.8 cms (Desviación estándar (DE)=1.9). Borde proximal 9.1 cms (DE 1.8).
Todos los pacientes recibieron neoadyuvancia con capecitabine y radioterapia con media de 49.5 Grys. Se evaluó por USE a las 9na semana.
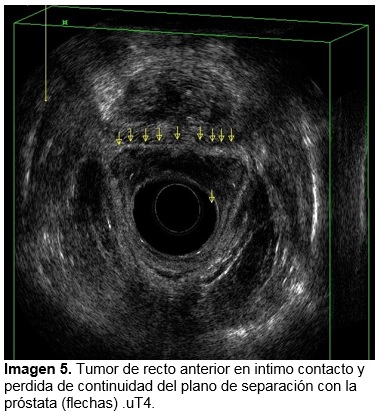
El 50 % en una etapa clínica III C por USE previo a la neoadyuvancia, un 66 % etapa clínica I posneoadyuvante por USE y 50 % etapa clínica I definida por pieza de patología. Ninguno de los pacientes evaluados tuvieron respuesta patológica completa. Ver tabla 1.
La eficacia en la evaluación posneoadyuvante del USE en comparación con la pieza de patología en la identificación de la invasión tumoral (T) fue del 83% y para ganglios el 66%, ver imagen 1 y 2.
Ninguno de los pacientes presentaba invasión al canal anal. Características ultrasonografías previo a la neoadyuvancia; longitud el tumor: media de 40.3 mm (DE 19.6), volumen tumoral 46.1 cm3 (DE 52.5), distancia entre el borde inferior del tumor y el esfínter anal interno 17.3 mm (DE 16.4), ver tabla 2.
Características ultrasonografías posneoadyuvancia; Longitud el tumor: media de 27.9 mm (DE 14.9), volumen tumoral 12.1 cm3 (DE 9.8) ver imagen 1, distancia entre el borde inferior del tumor y el esfínter anal interno 21 mm (DE 11.2) ver imagen 3. Promedio de porcentaje de regresión tumoral en la longitud del tumor 28.5 % y porcentaje de regresión tumoral en volumen 65%, ver imagen 4 y 5.
Siendo catalogados con respuesta clínica y patología parcial en el 100% de los pacientes (> 20% de regresión tumoral).
Del grupo de pacientes incluidos en nuestro estudio, en 4 de ellos se realizó IRM preneoadyuvancia, encontrando por estudio una media de volumen 30.88 cm3 (DE 9.0), ver imagen 3. Once pacientes no incluidos en nuestro grupo de estudio, por estenosis secundaria al tumor y/o dolor anal, se encontró por resonancia magnética un volumen tumoral medio de 60.3 cm3 (DE 69.8); 18% de ellos con respuesta patológica completa (RPC). De los 2 pacientes con RPC, presentaban volumen de 35.4 cm3 y 23.6 cm3, ambos con presencia > 4 ganglios regionales

DISCUSION
Nuestro servicio es un centro de referencia a nivel nacional para diagnóstico y tratamiento del cáncer de colon y recto. La mayoría de nuestros pacientes llegan en estadios avanzados, recibiendo solo manejo paliativo: derivación intestinal y quimioterapia. La detección oportuna y mejoras en los tratamientos han reducido la mortalidad en un 35% en los últimos 20 años.2
En el 2015 se publica la alta incidencia del cáncer colorrectal en menores de 50 años3, en nuestra institución del 2015- 2016 se detectaron 46 pacientes menores de 50 años con diagnóstico de cáncer de colon y recto, incluso en el 2017 con reporte de 3 casos de pacientes desde los 17 años en etapas localmente avanzadas del cáncer de recto de origen esporádico; es decir sin antecedentes de síndrome polipósicos.
Hablando del cáncer de recto, el protocolo de estatificación se encuentra estandarizado por las Guías 2018 de la NCCN (national comprehesive cancer network) de los Estados Unidos de Norteamérica, donde se menciona el USE 3 D, como parte del protocolo de estatificación y reestadiaje posneoadyuvante.
El ultrasonido endorrectal 3D es factible realizarse en tumores de tercio medio e inferior no estenosantes, con una especificidad del 50- 77 % al cumplir la curva de aprendizaje de 50 estudios. En nuestra institución se realizan 25 USE por año aproximadamente desde el 2014, capacitando 2 cirujanos colorrectales por año. A pesar de tener menor número de los reportados en la literatura para considerarse la curva de aprendizaje nos encontramos dentro del rango de eficacia en la evaluación pos neoadyuvancia por USE 3D.
Las ventajas del ultrasonido endorrectal vs la resonancia magnética es el bajo costo y mayor accesibilidad, con una eficacia en el estadiaje de la invasión del tumor (T) 68.6% para USE 3D vs 72.9% para Resonancia magnética, sin tener significancia estadística. 13 Aumentado su eficacia en lesiones tempranas T1-T2 hasta un 94% y en la detección de ganglios > 5 mm del 64-83%.14 La aplicación del USE 3D en la evaluación de la respuesta clínica posterior a la quimio y radioterapia aun es estudiada debido a la inflamación, necrosis y fibrosis que la misma terapia neoadyuvante ocasiona.22 En nuestro estudio la eficacia en la evaluación posneoadyuvante del USE en comparación con la pieza de patología en la identificación de la invasión tumoral (T) fue del 83% y para ganglios el 66%. No se comparó con la resonancia magnética debido a que no todos los pacientes se les realizaron dichos estudios.
Existe una evidencia de respuesta patológica completa (RPC) entre 8-25% después de la neoadyuvancia, siendo posible evitar cirugías respectivas extensas con alto índice de morbilidad.20 En nuestra institución se tiene una RPC del 18%, sin embargo de los pacientes evaluados con ultrasonido pre y posneoadyuvante 100% tuvieron una regresión tumoral parcial (>20 %) en cuanto a longitud del tumor, volumen y distancia del borde distal del tumor y el esfínter anal interno, lo que hace sospechar la poca respuesta debido a diagnóstico de etapas clínicas avanzadas; tumores estenosantes y con enfermedad tumoral a distancia.
Desde el 2002 García-Aguilar realizó un estudio retrospectivo con 545 pacientes, evaluando ultrasonidos endorrectales en el preoperatorio en cáncer de recto encontrando una exactitud en la profundidad de penetración de pared rectal solo del 69%, con un sobre estadio en el 18% y un 13% en reporte de estadio inferior.24 Determinando que esta técnica de evaluación posneoadyuvancia es más precisa si se distingue entre tumores en estadios iniciales y cáncer invasor. La diferencia en la interpretación de las imágenes puede explicar las discrepancias entre los resultados de los diferentes estudios.
En el 2011 M. Regadas en Brasil reporta los hallazgos ultrasonográficos endorrectales para evaluar la respuesta neoadyuvante clasificando respuesta completa (regresión total del tumor), parcial (disminución del tumor en > de 20% de la longitud y volumen) o insignificante (disminución < 20% del tamaño tumoral), esto mediante un ultrasonido endorrectal 3D (USE).23 Por lo anterior clasificamos a todos nuestros casos como respuesta parcial.
Metaanálisis y revisiones sistémicas en el 2015 reportan que debido a la heterogeneidad entre los estudios en el reestadiaje posneoadyuvancia es alta. La evaluación morfológica de la T y N (penetrantica tumoral en las capas rectales y ganglios linfáticos) ya sea por IRM y USE 3D no es precisa ni lo suficiente consistente en la aplicación clínica. Sin embargo la IRM aparente tener un rol importante en la exclusión del involucro del margen circunferencial libre de células malignas.26
En nuestro estudio solo se realiza análisis descriptivo por ser una muestra insignificante para el volumen de pacientes que se maneja en la institución, el ultrasonido endorrectal poco factible de realizarse por lo antes mencionado el diagnostico de tumores estenosantes y poca disponibilidad de insumos para el mismo equipo. Por lo que se ha apoyado en el mayor uso de la resonancia.
CONCLUSION
A pesar de tener el recurso del USE es poco factible realizarlo en nuestra población por encontrarse la mayoría con tumores estenosantes y como segunda causa por dolor anal a la exploración. El USE tiene una buena eficacia para calcular el porcentaje de regresión con respuesta clínica y patología parcial en el 100% de nuestros pacientes. Por lo que concluimos que el USE es un recurso más disponible para la evaluación pre y pos quimiorradioterapia.
REFERENCIAS