Rev Med UAS
Vol. 12: No. 4. Octubre-Diciembre 2022
ISSN 2007-8013
Armenta-Molina Josue1, Olivares-Acosta Ivan2, Candolfi-Arballo Ofelia3*
* Correspondencia: Ofelia Candolfi-Arballo.
Boulevard Universitario No. 1000, Valle de las Palmas, Tijuana, Baja California, México. C.P. 22260.
Tel: (6651041766). Correo electrónico: ocandolfi@uabc.edu.mx
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v12.n4.004
Texto Completo PDFRecibido 08 de septiembre 2022, aceptado 25 de octubre 2022
RESUMEN
Objetivo: Evaluar la inhibición del crecimiento de la bacteria Enterococcus faecalis (ATCC® 29212™) en presencia de cementos selladores (CS) utilizados en tratamientos endodónticos mediante experimentación in vitro. --- Materiales y Métodos: Se empleó un diseño metodológico de tipo experimental basado en ensayos de laboratorio. Se utilizó el método de difusión en agar para analizar la actividad antibacteriana de tres CS: EndoSequence (BC Sealer), AHPlus (Dentsply De Trey) y Sealapex (Kerr). Se organizaron los datos y se graficaron los resultados. --- Resultados: Se obtuvo una mayor inhibición del crecimiento bacteriano con el cemento AHPlus (1.50 mm), seguido de EndoSequence (1.10 mm), el CS Sealapex mostró muy poca actividad inhibitoria de E. faecalis (0.2 mm). --- Conclusión: La inhibición del crecimiento de E. faecalis por la presencia de los CS utilizados en endodoncia fue distinta entre sí, existe variabilidad importante en la capacidad antibacteriana de los CS analizados, los hallazgos de este estudio confirman los datos reportados en otros estudios, mientras que para algunos cementos fueron contrastantes.
Palabras clave: Enterococcus faecalis, inhibición bacteriana, cementos endodónticos.
ABSTRACT
Objective: To evaluate the inhibition of the growth of Enterococcus faecalis bacteria (ATCC® 29212™) in the presence of sealer cements (CS) used in endodontic treatments by means of in vitro experimentation. --- Materials and Methods: An experimental methodological design based on laboratory tests was used. The agar diffusion method was used to analyze the antibacterial activity of three CS: Endosequence (BC Sealer), AHPlus (Dentsply De Trey) and Sealapex (Kerr). The data were organized and the results were plotted. --- Results: The highest inhibition of bacterial growth was obtained with AHPlus cement (1.50 mm), followed by Endosequence (1.10 mm), the CS Sealapex showed very little inhibitory activity of E. faecalis (0.2 mm). Conclusion: The inhibition of the growth of E. faecalis by the presence of the CS used in endodontics was different from each other, there is significant variability in the antibacterial capacity of the CS analyzed, the findings of this study confirm the data reported in other studies, while for some cements were contrasting.
Keywords: Enterococcus faecalis, bacterial inhibition, endodontic cements.
INTRODUCCIÓN
El objetivo primario del tratamiento de conductos radiculares en endodoncia es preservar la integridad de las estructuras periapicales y, en caso de no existir, dar los medios propicios para devolver el estado de salud1.
Las bacterias y sus bioproductos son el principal factor etiológico en la patología pulpar y periapical, por lo tanto, la desinfección de forma eficiente del sistema de conductos radiculares es determinante en el éxito endodóntico1,2.
El tratamiento de conductos comprende varios pasos operatorios que juntos forman una cadena tan fuerte como su eslabón más débil, esos pasos operatorios son: la conformación, que implica dar una forma geométrica específica al sistema de conductos radiculares, la desinfección mediante agentes irrigantes bactericidas y la obturación, la principal función de este último paso de obturación es impedir la filtración y proliferación de bacterias mediante el sellado de los conductos radiculares previamente conformados3, este proceso se realiza con materiales que promueven la reparación apical y eviten propagación de las bacterias que pudieran encontrarse en zonas inaccesibles como tubulillos dentinarios, conductos laterales y conductos accesorios; mediante un sellado estable y tridimensional que no interfiera con el proceso de reparación4.
Se han recomendado un gran número de materiales para la obturación del sistema de conductos radiculares. La mayoría de las técnicas emplean un material sólido como la gutapercha y un cemento sellador. Independientemente del material sólido, un cemento es esencial para cada técnica y ayuda a lograr un sellado eficiente5.
Los cementos selladores son una interfaz entre el material de obturación sólido y la pared de dentina. Los selladores también ocupan espacios e irregularidades en el conducto radicular, los conductos laterales y accesorios, además de los espacios entre los conos de gutapercha accesorios utilizados en la técnica de compactación lateral. Además de servir como lubricantes durante el proceso de obturación6.
De acuerdo con los postulados de Grossman, definidos por primera vez en 1988, los requisitos ideales de un cemento sellador son: la habilidad para adherirse a la superficie radicular tridimensionalmente, no citotóxico y bien tolerado por los tejidos periradiculares, buena estabilidad dimensional, no reabsorbible, insoluble en tejidos orales, soluble con disolventes, fácil de manipular, buena radiopacidad, que no produzca corrosión, proveer un sellado hermético, no pigmentar la estructura, y ser bacteriostático o bactericida7.
La periodontitis apical es producto de la interacción entre los diferentes microorganismos presentes en las infecciones intraradiculares. Una de las principales causas de fracaso en endodoncia es la presencia de especies bacterianas, un claro ejemplo de este grupo es Enterococcus faecalis6, la cual es una bacteria gram positiva, comensal en el tracto gastrointestinal de los seres humanos. Se ha encontrado con frecuencia en los dientes con fracaso endodóntico en valores de prevalencia que van del 30 al 90%, además de tener nueve veces más probabilidades de encontrarse en este tipo de casos que en los casos de infecciones primarias8.
Una característica notable de E. faecalis la constituye su capacidad para sobrevivir y crecer en microambientes que pudieran ser inadecuados para un gran número de bacterias, esta capacidad de resistencia por parte de E. faecalis en microambientes complejos está relacionada con la supervivencia en los sistemas de conductos radiculares de dientes que han sido sometidos a tratamiento endodóntico y en los cuales los nutrientes son limitados8, éste es el motivo por el cual esta especie bacteriana es excelente para observar la capacidad bactericida o bacteriostática de diferentes materiales de uso endodóntico.
Los cementos de más uso en el área de endodoncia son los formulados a partir de óxido de zinc y eugenol, hidróxido de calcio, selladores a base de resina y los nuevos selladores biocerámicos9. A pesar de las afirmaciones de los fabricantes sobre las ventajas de cada clase de selladores y artículos científicos que los respaldan10–14, es importante generar más evidencia científica que demuestre la superioridad de un cemento sobre otro en cuanto a sus características utilidad se refiere, especialmente su capacidad antibacteriana.
Cementos a base de hidróxido de calcio.
Se crearon con la intención de incorporar las buenas propiedades biológicas del hidróxido de calcio a los selladores, evitando al mismo tiempo su rápida reabsorción en el periápice y en el interior del conducto. Se sugiere que el efecto antimicrobiano del hidróxido de calcio se produce por su capacidad de liberar iones Hidroxilo y por tener un pH alto. Lamentablemente estas acciones no se han demostrado. Se requiere solubilidad para la liberación de hidróxido de calcio y que su actividad sea constante, lo anterior es inconsistente con el propósito de un sellador3,15–19.
Cementos selladores a base de resina.
Fueron introducidos en la práctica endodóntica por sus características favorables, como la adhesión a la estructura dentaria, largo tiempo de trabajo, facilidad de manipulación y buen sellado20.
Cementos selladores biocerámicos.
Son biocompatibles, no producen respuesta inmunológica periapical, son estables en ambientes biológicos y no sufren contracción. Poseen la capacidad de producir hidroxiapatita durante su proceso de fraguado, generando un enlace químico entre la dentina y el material de obturación. Son fáciles de usar, ya que poseen un tamaño de partícula menor a 2 μm, lo que permite ser usados en una jeringa pre mezclada, presentan además un pH muy alcalino durante las primeras 24 horas lo que se traduce a una elevada actividad antimicrobiana21–23.
Se ha estudiado con anterioridad la actividad antimicrobiana de cementos selladores frente a distintas bacterias10,11,13,15,19,24, específicamente frente a E. faecalis25–32, sin embargo, es importante probar la actividad antimicrobiana de cementos novedosos empleados en la actualidad y comparar su efectividad.
El objetivo de este estudio fue evaluar la inhibición del crecimiento de la bacteria Enterococcus faecalis (ATCC® 29212™) en presencia de cementos selladores utilizados en tratamientos endodónticos mediante experimentación in vitro.
MATERIALES Y MÉTODOS
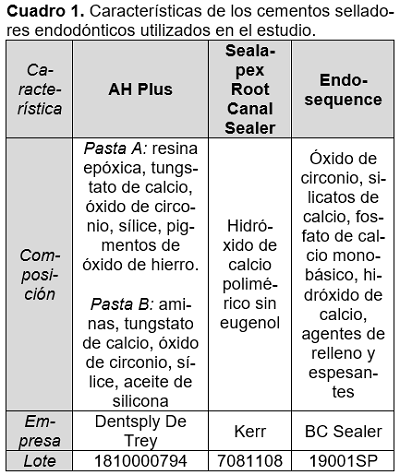
Se empleó un diseño metodológico de tipo experimental basado en ensayos de laboratorio. Se utilizó el método de Difusión en agar (Kirby Bauer)33–35, para analizar la actividad antibacteriana de tres cementos selladores de diferente composición: Endosequence (BC Sealer), AHPlus (Dentsply De Trey) y Sealapex (Kerr) (Cuadro 1). A continuación, se describen las principales etapas del trabajo de laboratorio.

Preparación del medio de cultivo.
Se empleó el medio de cultivo Agar Muller-Hinton (Becton Dickinson®), se preparó con las instrucciones que indica el fabricante; se mantuvo a temperatura ambiente una hora antes de utilizarlo.
Preparación del inóculo.
Se utilizó el método de suspensión directa de colonias, a partir de una placa de cultivo de 24 horas de la bacteria Enterococcus faecalis (ATCC® 29212™) se seleccionaron primeramente de 4 a 6 colonias y se ajustó el inóculo a una turbidez equivalente al 0.5 de la escala de MacFarland, se utilizó vórtex durante 15-20 segundos para homogenizar.
Inoculación de las placas.
Durante los primeros 15 minutos posteriores al ajuste del inóculo, se introdujo un asa bacteriológica dentro de la suspensión y se recolectó una cantidad con la cual se inocularon las placas de agar previamente preparadas con la técnica de inoculación en césped, sin dejar ninguna zona libre del agar. Se dejaron secar de 3 a 5 minutos para posteriormente depositar los discos.
Colocación de los discos con cementos en el medio de cultivo.
Los discos de papel filtro se impregnaron con cada cemento, preparados según las indicaciones del fabricante, con pinzas estériles se colocaron manualmente de 5 a 6 discos equidistantes por placa de agar, presionando ligeramente la parte superior del disco asegurando que hicieran contacto perfectamente con la superficie del agar. Posteriormente, las placas se colocaron en incubación de forma invertida a 37 grados centígrados, en atmósfera aeróbica por 24 horas.
Lectura de los resultados.
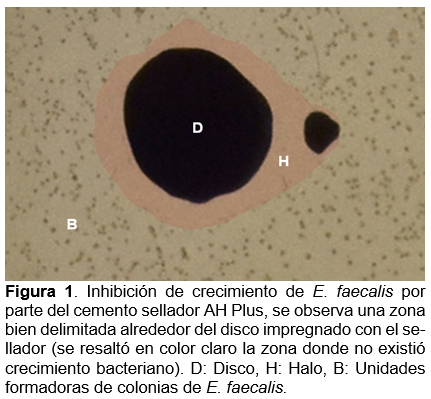
Se midieron las zonas de completa inhibición del crecimiento bacteriano con un vernier o regla, contra una superficie oscura bajo luz reflejada sobre el respaldo de la caja de Petri sin remover la tapa. El punto final de inhibición completa del crecimiento se estimó a simple vista.
Los tres cementos que se utilizaron para esta investigación se encuentran descritos en el cuadro 1 donde se indica la composición, el lote y la marca de la empresa que los desarrolla.
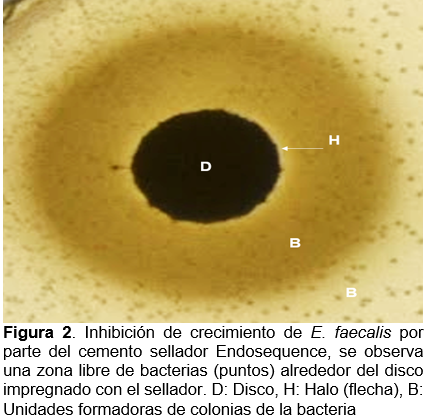
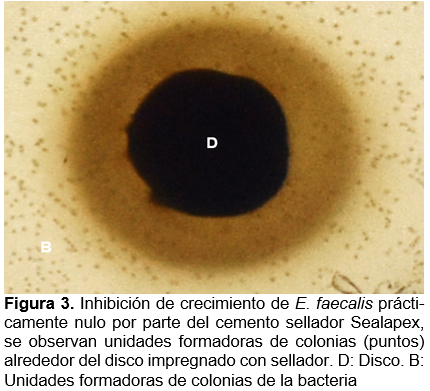
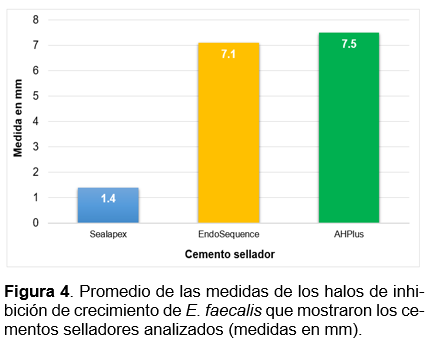
El cemento sellador cuya inhibición del crecimiento de E. faecalis fue prácticamente nula fue Sealapex, ya que solo en una medición resultó tener 1 mm de inhibición del margen del disco a la aparición de las unidades formadoras de colonia de las bacterias, solo en ese caso se consideró el diámetro del disco (7 mm en total), mientras que en todas las demás mediciones la inhibición fue prácticamente inexistente (1.4 mm en promedio de todas las mediciones) (Figura 3 y 4).
DISCUSIÓN
La mayoría de los fracasos en un tratamiento endodóntico resultan ser por la ineficiencia en el proceso de desinfección de los conductos, así como la complejidad de realizar el proceso, sobre todo en los conductos accesorios18. Cada vez se realizan mejoras en los protocolos químico mecánicos para aumentar la efectividad en la desinfección, siendo los cementos una parte muy importante ya que con el sellado se busca inhibir el crecimiento de bacterias que pueden ocasionar fracasos en el tratamiento y comprometer la salud del paciente30.
En esta investigación se analizó, mediante experimentación in vitro, la inhibición del crecimiento bacteriano ocasionada por cementos utilizados en tratamientos endodónticos, dentro de los principales hallazgos se demostró que el cemento AHPlus tiene una buena actividad antibacteriana, no así en el caso del cemento Sealapex, posiblemente se requieran hacer más pruebas con diferentes concentraciones para poder evaluar la eficiencia en su uso.
Los resultados fueron constantes para los tres cementos (n=20) en todos los ensayos.
Resultados similares fueron descritos por Poggio y colaboradores (2017), donde el cemento AHPlus presentó una importante inhibición de crecimiento bacteriano (1.2mm), en comparación con Sealapex (0.2mm)30. Para el caso del cemento EndoSequence, Singh y colaboradores (2019) resaltaron que la medida promedio de la inhibición fue de 14.4mm10, significativamente mayor a la mostrada en éste ensayo donde se obtuvieron medidas menores y el promedio resultó de 7.1 mm, se conserva la capacidad de inhibición bacteriana pero sugiere continuar con el análisis de este material en próximas investigaciones.
Un estudio que contrasta los resultados que se presentan es el de Barbosa y colaboradores (2020), ya que, aunque muestra resultados midiendo parámetros distintos a los de este estudio (UFC/ml vs inhibición de UFC en medio sólido), resultó mayor crecimiento de células bacterianas en presencia del cemento AHPlus (9.16 UFC/ml), por su parte, EndoSequence mostró menos crecimiento bacteriano (8.82 UFC/ml) y Sealapex arrojó el menor número de bacterias (8.75 UFC/ml), lo cual indica que la mayor inhibición la presentó Sealapex18, contrario a lo observado en éste estudio.
Los hallazgos de Heredia et al. (2017) muestran resultados relativamente diferentes, ya que observaron un halo de inhibición de 6 mm con el cemento Sealapex36, mientras que en los resultados de este estudio fue prácticamente nula la inhibición, en este caso es importante hacer notar la naturaleza del cemento, porque aunque se observó un halo de 6 mm en el cemento a base de hidróxido de calcio (Sealapex), se sigue conservando un efecto inhibitorio mayor en cementos a base de resina como Topseal (7.7 mm)36 o AHplus (7.5 mm en este estudio) lo que sugiere que la naturaleza y del cemento podría ser clave para inferir su capacidad inhibitoria, independientemente de la empresa que lo elabora36.
Los tres cementos que se evaluaron son los más utilizados en el medio académico y profesional donde se desarrolló la presente investigación, siendo ésta una de las razones principales por las cuales se eligió evaluarlos, sin embargo, existe gran variabilidad de cementos que se podrían analizar proponiendo nuevas preguntas a responder para investigaciones posteriores, adicionalmente, será importante utilizar diferentes métodos y otros microorganismos para observar y evaluar la inhibición bacteriana en otros modelos.
El beneficio de contar con el mejor agente antibacteriano para sellar los conductos endodónticos es muy importante en el resultado final del tratamiento. Medir la inhibición del crecimiento bacteriano permite al profesionista elegir la mejor opción y utilizarla en la práctica clínica, tanto en el medio privado como en los tratamientos realizados en la comunidad universitaria, favoreciendo la disminución casos de fracaso endodóntico por contaminación.
CONCLUSIÓN
La inhibición del crecimiento de E. faecalis por la presencia de los cementos selladores utilizados en endodoncia fue distinta entre sí, demostrando que existe variabilidad importante en la capacidad antibacteriana de los cementos selladores analizados. Los hallazgos de este estudio confirman los datos reportados en otros estudios con los cementos AHPlus y EndoSequence, mientras que para Sealapex algunos de los resultados fueron contrastantes generando oportunidades de análisis en investigaciones posteriores.
REFERENCIAS