Rev Med UAS
Vol. 12: No. 1. Enero-Marzo 2022
ISSN 2007-8013
Medina-de la Cruz Omar1,2, Villegas-Hinojosa Edgar1, Ruíz-Baca Estela3, Gallegos-García Verónica1*
*Autor de correspondencia: Gallegos-García Verónica
Facultad de Enfermería y Nutrición, Universidad Autónoma de San Luis Potosí, San Luis Potosí, México.
Dirección: Av. Niño Artillero No. 130. Zona Universitaria. C.P. 78240. veronica.gallegos@uaslp.mx
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v12.n1.008
Texto Completo PDFRecibido 30 de marzo 2021, aceptado 28 de julio 2021
RESUMEN
El Cáncer Cervicouterino (CaCu) es una de las principales causas de morbimortalidad a nivel mundial y en México. Esta enfermedad requiere de la presencia del Virus del Papiloma Humano (VPH) para su progreso a Neoplasia Intraepitelial Cervical (NIC), pero además de otros cofactores. Entre estos se han propuesto los cofactores ambientales o exógenos, los de tipo viral, del huésped o intrínsecos y los de tipo social. Esta revisión aborda los de tipo ambiental, entre ellos están: el uso de anticonceptivos hormonales orales, hábito tabáquico, exposición al humo de biomasa, la dieta, trauma cervical, Inicio de Vida sexual a Edad Temprana (IVSET), múltiples parejas sexuales, coinfección con otras enfermedades de transmisión sexual, no utilización del preservativo y la circuncisión de la pareja. Los cofactores modulan el progreso de los distintos grados de NIC a CaCu, por ello es importantes conocerlos y analizar de qué manera influyen en la aparición esta patología.
Palabras Clave: Virus del Papiloma Humano, Cáncer Cervicouterino, Cofactores ambientales
ABSTRACT
Cervical Cancer (CC) is one of the main causes of morbidity and mortality worldwide and in Mexico. This disease requires the presence of the Human Papilloma Virus (HPV) for its progress to Cervical Intraepithelial Neoplasia (CIN), but in addition to other co-factors. Among these, environmental or exogenous cofactors, those of the viral, host or intrinsic and those of the social type have been pro-posed. This review addresses those of an environmental nature, among them are: the use of oral hormonal contraceptives, smoking, exposure to biomass smoke, diet, cervical trauma, Early Sexual Life Onset (IVSET), multiple sexual partners, co-infection with other sexually transmitted diseases, non-use of condoms and circumcision of the couple. The co-factors modulate the progress of the differ-ent grades of CIN to CC, therefore it is important to know them and analyze how the influence the appearance of this pathology.
Keywords: Human Papillomavirus, Cervical Cancer, Environmental Co-factors.
Introduction
Actualmente las enfermedades no transmisibles son responsables de la mayoría de muertes a nivel mundial, una de las principales causas es el cáncer y se considera una barrera para aumentar la esperanza de vida en el siglo XXI1. La incidencia y la mortalidad por cáncer ha aumentado, las razones son complejas como los cambios en la prevalencia y la distribución de cofactores para el desarrollo de neoplasias2.
De acuerdo a Global Observatory Cancer (GLOBOCAN) en el 2018 hubo 569,847 nuevos casos de Cáncer Cervicouterino (CaCu) y 311,365 defunciones a nivel mundial1. En México en ese año se diagnosticaron 7,869 nuevos casos y 4,121 muertes, siendo la segunda causa de muerte por cáncer en mujeres solo después del cáncer de mama3.
Antes de progresar a CaCu la zona de transformación del cérvix pasa por diferentes cambios que van desde una infección por VPH hasta el desarrollo de una Neoplasia Intraepitelial Cervical (NIC I, NIC II y NIC III) de acuerdo a la clasificación de Richart4. Existen otros cofactores importantes que se encargan de modular la infección por VPH e influyen en el riesgo de progresión 5. Estos se pueden clasificar en tres grupos; 1) cofactores ambientales o exógenos, 2) cofactores virales, 3) cofactores del huésped o intrínsecos, 4) cofactores sociales 5-11, en esta revisión nos centraremos en describir los cofactores ambientales.
Cofactores ambientales o exógenos
Las diferencias geográficas en la distribución del cáncer pueden deberse en parte a la variación humana individual, en la activación y desintoxicación de carcinógenos ambientales, a continuación, se abordan algunos de los cofactores ambientales importantes para el desarrollo de NIC12.
Anticonceptivos orales
La Zona de Transformación (ZT) del cuello uterino en donde el VPH inicia una NIC, depende de hormonas esteroides como la progesterona que influye sobre el efecto que ocasiona el VPH en las células epiteliales cervicales13. El uso de Anticonceptivos Orales (AO) como cofactor no está bien establecido, la International Agency Research of Cancer (IARC) clasificó a los anticonceptivos hormonales combinados de estrógeno-progestina y la terapia de reemplazo hormonal como cancerígenos para los humanos 14.
Un estudio multicéntrico realizado por la IARC encontró que el uso de AO por menos de cinco años no tiene relación con el desarrollo de CaCu, aunque el riesgo incremento casi tres veces más la probabilidad para las pacientes que lo usaron entre 5-9 años más y las mujeres que tomaron AO por más de 10 años tenían cuatro veces más la probabilidad de desarrollar CaCu respecto a las que no 15.
Las hormonas sexuales se relacionan como cofactores que favorecen los efectos celulares de la infección por VPH y existen varios mecanismos por los cuales ocurre esto. Uno de ellos menciona que los AO contienen estradiol y progesterona, estas hormonas se unen y activan los receptores de estrógenos (ERα y ERβ) y progesterona (PR-A y PR-B) respectivamente activando factores de transcripción dependientes de ligando que podrían estar jugando un papel clave en la progresión y desarrollo de CaCu16.
Otro mecanismo menciona que la ausencia de hormonas como el estrógeno en el receptor ERα y ERβ es inactivo y se localiza en el núcleo de la célula blanco como un gran complejo asociado a proteínas de choque térmico. Sin embargo, cuando la hormona se une a su receptor, se produce un cambio conformacional que provoca la dimerización del receptor adquiriendo la capacidad de unión a secuencias específicas reguladoras de la transcripción del Ácido Desoxirribonucleico (ADN) del VPH 17,18
La progesterona estimula la integración del ADN del VPH-16 en el genoma del huésped, de esta manera aumenta la expresión de las oncoproteínas E6/E7 del VPH que actúan en la regulación del ciclo celular y la apoptosis degradando genes supresores de tumores como p53 y de esta manera se induce la carcinogénesis 6. En el 2014 se comparó el transcriptoma de pacientes con CaCu que utilizaron o no AO para identificar la Expresión Diferencial de Genes (EDG), se identificaron 80 genes y se confirmó que el proceso metabólico se enriqueció en la EDG en pacientes con CaCu19.
Hábito tabáquico
La exposición a carcinógenos como los del humo del tabaco, se han sugerido como un posible cofactor promotor de CaCu 12. El humo del tabaco contiene y libera más de 6,000 compuestos, algunos de los cuales son agentes carcinógenos que ya se conocen como: bencil (a) pirenos, Hidrocarburos Aromáticos Policíclicos (HAPs) y nitrosaminas específicas del tabaco. Uno de los principales compuestos es el 4-(metilnitrosamino)-1-(3-piridil)-1-butanona o NNK 20,21.
El moco cervical de fumadoras contiene tres veces los niveles de NKK respecto a las no fumadoras, el mecanismo de transporte es que llegan a las células epiteliales cervicales a través de la sangre 20. Los carcinógenos del cigarrillo crean aductos en el ADN y se han detectado algunos compuestos sobre células epiteliales cervicales, esto sugiere un papel potencial de tales carcinógenos en la patogénesis de CaCu 12.
En investigaciones en líneas celulares cervicales con genomas episomales de VPH expuestos al humo de tabaco se observó mayor expresión del oncogén E6 y E7, esto sugiere un papel importante en la modulación del VPH en el desarrollo de CaCu22. Baltazar-Rodríguez en su estudio en mujeres con CaCu considera el hábito tabáquico como el haber consumido más de 100 cigarrillos durante la vida 23.
Exposición al humo de biomasa
La literatura científica al menos en Latinoamérica indica que la inhalación de aire contaminado a través de la combustión de carbón, madera (como la leña, ya que aún existe esta práctica para la cocción de los alimentos) o paja se asocia con la incidencia de enfermedades como cáncer de pulmón, del tracto digestivo superior; en el CaCu la información es controversial 12.
Durante la combustión de leña se liberan HAPs (considerados mutagénicos y cancerígenos) como benzopirenos, dibenzoantracenos y dibenzocarbazoles; otros productos que también se liberan son aldehídos, fenoles, cresoles, quinonas, óoxidos de nitrógeno y azufre, hidrocarburos alifáticos y monóxido de carbono 24. Estos productos han sido considerados por la IARC como posibles cancerígenos en humanos 12.
En Honduras un estudio en pacientes con CaCu encontró que el número de años en donde las mujeres estuvieron expuestas al humo de biomasa fue mayor en los casos respecto a los controles, el Odds Ratio (OR) fue 3.67 en mujeres con 25-34 años de exposición al humo, mientras que las que tenían más de 35 años expuestas el OR fue de 6.357. La exposición por varios años puede tener un efecto biológico en la progresión de las lesiones pre-neoplásicas del epitelio cervical, induciendo la acumulación de daño genético a manera de aberraciones cromosómicas y mutaciones genéticas, como se ha propuesto para otros carcinógenos ambientales, favoreciendo así la aparición de NIC en mujeres positivas a VPH 21.
Dieta
El estilo de vida es una forma de proporcionar, mantener y mejorar la salud, por lo tanto, el cáncer puede prevenirse mediante la modificación de hábitos alimenticios25. Una alimentación saludable que incluya el consumo de frutas, verduras y la ingesta de algunos nutrientes (antioxidantes, folatos y minerales) se asocia a una disminución del riesgo de infección por VPH y su progreso a NIC8. La relación entre la carcinogénesis cervical y la dieta no están completamente descritas, aunque la presencia de algunos micronutrientes como carotenoides, tocoferoles, vitaminas y minerales modifican el progreso de la infección por VPH a CaCu26.
En el 2010 se demostró que frutas y verduras que contienen vitamina C y retinol contribuyen a disminuir la carga viral de VPH y el progreso a NIC27. La vitamina C es participa en reacciones de hidroxilación en donde se involucra el oxígeno molecular, nitratos, inhibe la carcinogénesis y reduce el daño en los cromosomas de las células 28.
González-Acevedo y cols. demostraron que las mujeres con mayor ingesta de vitamina C y de Zinc presentan menor riesgo para desarrollar CaCu 29. La vitamina C podría estar actuando como eliminador de radicales libres y oxidantes, ya que si no se pueden neutralizar la inflamación causada por VPH puede provocar daño en el ADN 30,31.
El Zinc es una línea de defensa de las células contra especies reactivas de oxígeno para eliminar el anión superóxido, además la asociación entre la deficiencia de Zinc y el cáncer ha sido descrita debido a que juega un papel indispensable en la protección del daño en el ADN por su actividad antioxidante y es un componente que participa en los mecanismos de reparación del ADN29.
Entre los antioxidantes dietéticos que pueden actuar en diferentes etapas de la historia natural del CaCu se encuentran la vitamina A, la vitamina D y la papaya, estos pueden ser más efectivos para prevenir la displasia temprana (NIC I) [31]. En contraste la vitamina E y el licopeno, pueden tener más efecto para prevenir la displasia tardía (NIC II y NIC III), otros alimentos como las verduras contribuyen a prevenir la infección por VPH, la NIC I-III y el CaCu 31,32. Las vitaminas A, C, D y E contribuyen en la inhibición de células tumorales, pueden estabilizar la proteína p53, prevenir el daño del ADN celular y reducir la inmunosupresión 31.
En el año 2012 se realizó un metanálisis y los resultados indican que la ingesta de vitamina A esta asociada con un riesgo reducido por CaCu. El consumo de retinol (OR=0.80) tiene una asociación débil para el riesgo de CaCu, pero el consumo de caroteno (OR=0.51) y carotenoides (0R=0.48) tienen una fuerte asociación inversa con el riesgo de cáncer 33.
Las vitaminas protegen a las células de los efectos secundarios de especies reactivas de oxígeno; la vitamina A puede actuar en la división y diferenciación celular, regula el sistema inmunitario, previene el desarrollo de células cancerosas, proporciona propiedades antimutagénicas, antitumorales, inmunoestimulantes, antiulcerosas y degenerativas en el humano34. Los carotenoides y los tocoferoles tienen actividades antioxidantes y efectos moduladores sobre la inmunidad, aunque deben realizarse más estudios para un mejor entendimiento de como los alimentos tienen este efecto35.
Trauma cervical
Los incidentes que pueden ocasionar traumatismos en el cuello uterino, se consideran cofactores de riesgo para el desarrollo de CaCu. Las mujeres que se encuentran más susceptibles a esto son las que han sufrido laceraciones en el cérvix, mutilación genital, pacientes que han tenido partos por vía vaginal, aquellas con antecedentes de episiotomía, por mencionar algunas causas10.
En mujeres de Sudan se encontró que aquellas que tuvieron algún tipo de trauma cervical eran aproximadamente nueve veces más propensas al CaCu en comparación con las mujeres que no lo tuvieron 10. Las mujeres con cesárea mostraron riesgo reducido para el desarrollo de neoplasia respecto a las pacientes que tenían partos vaginales 36.
Los cambios metaplásicos que se desarrollan por el trauma cervical durante el trabajo de parto, se han identificado como riesgo mayor para aquellas mujeres que son multíparas36. El riesgo de CaCu se incrementó en más de dos veces en aquellas pacientes que tuvieron más de cuatro hijos respecto a las que solo tenían uno o ninguno 37,38.
Panjaliya menciona que el trauma del cérvix durante el parto deja la ZT expuesta lo que facilita una infección por VPH, además de que puede haber otras causas para una mayor susceptibilidad a infección como la inmunosupresión, la influencia de las hormonas y la dieta 39. La episiotomía, la laceración cervical y la mutilación genital son los principales tipos de traumas cervicales iatrogénicos 40.
Inicio de vida sexual a edad temprana
El CaCu se desarrolla en la ZT, esta es la unión entre el epitelio columnar de una sola capa y el epitelio escamoso estratificado distal, creando de esta manera la unión escamo-columnar. Durante la adolescencia esta ZT está activa y se encuentra evertida hacia el exocérvix quedando más expuesta y de esta forma durante el coito el VPH puede llegar e integrarse en las células epiteliales 41.
En una investigación del 2008 argumentan que las mujeres que inician su vida sexual antes de los 20 años son más susceptibles a contraer una infección por VPH 23. Durante la pubertad los tejidos cervicovaginales son más susceptibles ante agentes cancerígenos ya que la ZT es más proliferativa, además con la posibilidad de tener múltiples compañeros sexuales y mayor riesgo de exposición al VPH 42.
Otro estudio realizado en el estado de Zacatecas observó que el riesgo de NIC es mayor cuando el IVSET, en pacientes que iniciaron su vida sexual antes de los 15 años tuvieron un riesgo de dos veces mayor respecto a las que iniciaron después de los 20 años 43.
Múltiples parejas sexuales
Diferentes estudios epidemiológicos muestran que el comportamiento sexual es un factor determinante para adquirir una infección por VPH, en aquellos con múltiples parejas sexuales44. Cuanto mayor sea el número de parejas sexuales que una mujer tenga sin el uso de preservativo, mayor será el riesgo de entrar en contacto con el VPH 45.
En un estudio de casos y controles realizado por Kashyap menciona un OR=5 para el desarrollo de CaCu en pacientes con más de tres parejas sexuales respecto a las que solo tuvieron una 11. Se ha sugerido que la mayoría de infecciones por VPH de alto riesgo sucede en mujeres jóvenes, estas suelen ser transitorias e involucran contactos sexuales con nuevas parejas, sin embargo, pueden persistir en algunas mujeres 46.
Se ha propuesto que la actividad sexual de mujeres solteras tiende a ser de manera esporádica, aunque se ha observado que existe una creciente prevalencia del sexo fuera del matrimonio 47,48. Los hombres juegan un rol importante en el aumento del riesgo para que sus parejas desarrollen CaCu, sin dejar de lado que un mayor número de parejas sexuales aumenta el riesgo de infectarse por VPH 49.
Un factor de confusión importante es el número de parejas sexuales que haya tenido durante su vida la pareja actual, ya que en los estudios no hay datos sobre el patrón de comportamiento sexual de los hombres u otros datos relevantes acerca de ello 50. Un estudio en España indica que la presencia de ADN del VPH en el pene del esposo aumenta en cinco veces más el riesgo de sus esposas para desarrollar CaCu 51.
El comportamiento sexual puede tener más variables, sin embargo, debido al sesgo de deseabilidad social, la tendencia en los participantes de los estudios puede responder a las expectativas sociales de lo que es aceptable, algunas encuestas han encontrado que las mujeres tienden a subestimar el número de parejas sexuales52. Por lo tanto, se deben realizar más investigaciones que permitan conocer más sobre esto y su asociación con el desarrollo de CaCu.
Coinfección con otras enfermedades de transmisión sexual
Las mujeres entre los 15-24 años tienen tasas más altas de infecciones de transmisión sexual, entre las que se incluye Chlamydia trachomatis, Neisseria gonorrhoeae, Trichomona vaginalis y VPH 53. Estos pueden ocasionar inflamación local y pueden contribuir al VPH y la progresión de la lesión cervical 54.
Se sabe que las células epiteliales columnares son objetivos para la infección por C. trachomatis y N. gonorrehoeae, mientras que la zona de transformación es ideal para la infección por VPH ya que requiere de la replicación de la célula huésped y la diferenciación para su replicación 53. Amorim detectó T. vaginalis en el 61.3% de mujeres con algún grado de NIC, por lo tanto, hubo mayor riesgo relacionado con la presencia de este microorganismo y el desarrollo de lesiones cervicales 54.
La respuesta inflamatoria por los microorganismos en el sitio de infección induce al daño celular que sugiere lesiones cervicales 54. C. trachomatis infecta las células epiteliales del tracto genital, de esta manera produce inflamación y está implicada en el riesgo de NIC 55. Un estudio de cohorte con un seguimiento de 19 años mostró que la infección repetida por C. trachomatis aumenta el riesgo de NIC entre las mujeres con una infección persistente por VPH de alto riesgo 56.
El rol que juega una ETS como cofactor de VPH es la de facilitar la entrada y la persistencia del VPH por la inflamación cervical crónica, ulceración del epitelio cervical y reducción de la inmunidad 57. La investigación de Abreu y cols. indico que la coinfección de VPH y C. trachomatis exhibió cinco veces más el riesgo de una NIC 58.
No utilización de métodos de barrera
La prevención primaria basada en métodos anticonceptivos de barrera como el preservativo (condón) y la circuncisión son métodos eficientes, aunque por la población hay muy poca inclinación para aceptar este tipo de métodos. Para lo cual es importante difundir información adecuada para disminuir ETS 59.
El condón confiere protección contra el VPH de diferentes maneras: 1) su uso reduce la infección por VPH y la reinfección, así el sistema inmunitario repara la lesión cervical; 2) el semen tiene un efecto inmunosupresor, esto es una ventaja en el proceso reproductivo pero cuando existen lesiones cervicales, la ausencia de semen ayuda a la respuesta inmune celular; 3) el látex de los condones es un material ajeno al cuerpo que puede desencadenar la respuesta inmune celular y contribuir a la regresión de una lesión 60.
En el 2008 la Food and Drug Administration (FDA) cambio el etiquetado de los condones y los reconoce útiles para prevenir la infección por VPH y otras ETS 61. Winer menciona que las mujeres cuyas parejas usaron condones el 100% del tiempo durante 8 meses anteriores redujeron las probabilidades de contraer el VPH respecto aquellas cuyas parejas usaron condones menos del 5% de las veces 62. Se debe tomar en cuenta que pueden existe errores en la colocación del condón, problemas como roturas, deslizamientos o aplicación tardía son de las más comunes; lo anterior no se toma en cuenta al momento de realizar los estudios 63.
Circuncisión masculina
Cuando la circuncisión masculina (CM) se realiza en la infancia ofrece diferentes beneficios, como la protección contra infecciones del tracto urinario64. Se ha demostrado la vulnerabilidad del prepucio a diferentes ETS como el virus de inmunodeficiencia humana (VIH), ya que la cavidad del prepucio tiene un gran microbioma y la superficie de la mucosa contiene células diana para agentes infecciosos 65.
Las mujeres con parejas con CM tienen menos probabilidad de adquirir ETS, también se asocia a un menor riesgo del desarrollo de CaCu, de NIC, infección por el virus del herpes simple tipo 2, clamidia y sífilis 66. Se han comparado la prevalencia de VPH en hombres con y sin circuncisión, en diferentes países, razas y edades 9. Un estudio de New England Journal of Medicine en el 2002 encontró que el VPH se detectó en 19.6% en 847 hombres sin CM respecto al 5.5% que corresponde a 292 hombres que la tenían 67. Otro estudio realizado en Dinamarca menciona que estar sin CM se asocia a una probabilidad de cinco veces más de tener una infección por VPH 68.
En México una investigación en hombres que acudieron a realizarse la vasectomía tenían un riesgo de cinco veces más de tener una infección por VPH si no se les había realizado la circuncisión 69. Otro estudio en el que participaron militares sanos identificó un OR 10 veces mayor a la infección por VPH en aquellos sin circuncisión 70.
Los hombres sin circuncisión tienen más posibilidad de infectarse por VPH, ya que en el coito el revestimiento interno del prepucio queda expuesto a secreciones vaginales. Después del coito, el inoculo de VPH queda atrapado en la cavidad del prepucio y se transmite a las células de la superficie a las capas basales, de esta manera se producen cambios en las células basoloides y el virus se puede replicar, así durante las siguientes relaciones sexuales se puede producir una infección en la ZT 65.
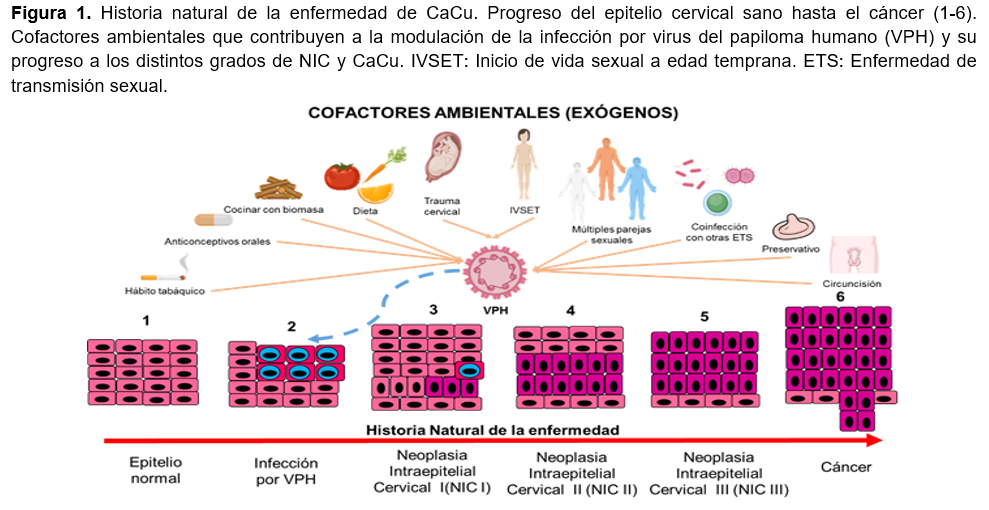
La cavidad del prepucio tiene un ambiente húmedo, esto proporciona un ambiente favorable para la infección por VPH en comparación con los que tienen CM 71. Otra explicación es que el VPH se replica en células epiteliales basales de la epidermis, sin embargo, después de la circuncisión la queratinización de la cicatriz quirúrgica y el tejido circundante puede ayudar a reducir dicha infección 9. En la Figura 1 se muestra un resumen de los cofactores mostrados en esta revisión.

Conclusión
Los cofactores ambientales o exógenos dependen directamente de las mujeres, por lo tanto, son cofactores que pueden ser modificados y de esta manera contribuir a disminuir la persistencia de una infección por VPH y su progreso mediante educación para la salud y prevención primaria en los sistemas de salud y así evitar el desarrollo a una NIC que podría tener como consecuencia la evolución al CaCu.
REFERENCIAS