Rev Med UAS
Vol. 11: No. 4. Octubre-Diciembre 2021
ISSN 2007-8013
Inzunza-Cervantes Gustavo1,*, Herrera-Gavilanes Juan Ramón1, López-López Roció Milagro2, Ornelas-Aguirre José Manuel3, Vidal-Morales René2, Peña Valenzuela Alibe Natanai4
*Autor de correspondencia:Dr. Gustavo Inzunza-Cervantes
Blvd. Real del Arco, 220. Fraccionamiento Real del Arco, Cp 85150 Ciudad Obregón Sonora.
Correo electrónico: gusinzunza@live.com.mx Teléfono: +52 (66) 7191-9895
DOI http://dx.doi.org/10.28960/revmeduas.2007-8013.v11.n4.008
Texto Completo PDFRecibido 24 de noviembre 2020, aceptado 25 de mayo 2021
RESUMEN
El síndrome de insuficiencia cardíaca es una entidad de alto impacto sanitario y social. Desencadenada por un desequilibrio entre el gasto cardiaco y las demandas del organismo, que durante las últimas décadas ha presentado grandes y constantes avances que hacen necesaria su frecuente revisión y análisis; su etiología es heterogénea, siendo la hipertensión arterial y la cardiopatía isquémica las principales causas; en su desarrollo se incluyen mecanismos fisiopatológicos que aún no han sido totalmente esclarecidos, las manifestaciones clínicas incluyen una constelación de síntomas inespecíficos ocasionados por alteraciones en la contractilidad miocárdica, el llenado ventricular o por consecuencia de los mecanismos de compensación; el abordaje diagnóstico parte de la sospecha clínica, apoyada en pruebas paraclínicas como la concentración sanguínea del péptido natriuretico, estudios de radiodiagnóstico y ecocardiografía; el plan terapéutico se basa en la prevención y control de factores de riesgo, la modulación farmacológica de la actividad neurohormonal asociado al uso de dispositivos cardiacos implantables cuando sea necesario por la complejidad del caso. La presente revisión narrativa no sistemática tiene como objetivo describir y recopilar la información de investigaciones y publicaciones existentes acerca de esta patología cardiovascular, otorgando un enfoque teórico, clínico y terapéutico aplicable a los tres niveles de atención en salud.
Palabras clave: insuficiencia cardiaca, falla cardiaca, disfunción ventricular, fracción eyección reducida.
ABSTRACT
Heart failure syndrome is an entity with a high health and social impact. It is triggered by an imbalance between cardiac output and the demands of the organism, that during the last decades has presented great and constant advances that require frequent review and analysis; its etiology is heterogeneous, with arterial hypertension and ischemic heart disease the main causes; Its development includes pathophysiological mechanisms that have not yet been fully clarified. The clinical manifestations include a constellation of nonspecific symptoms caused by alterations in myocardial contractility, ventricular filling or as a consequence of compensation mechanisms; the diagnostic approach starts from the clinical suspicion, supported by paraclinical tests such as the blood concentration of the natriuretic peptide, radio-diagnostic studies and echocardiography; The therapeutic plan is based on the prevention and control of risk factors, the pharmacological modulation of neurohormonal activity associated with the use of implantable cardiac devices when necessary due to the complexity of the case. The present non-systematic narrative review aims to describe and compile the information from existing research and publications about this cardiovascular disease, providing a theoretical, clinical and therapeutic approach applicable to the three levels of health care.
Keywords: heart failure, heart failure, ventricular dysfunction, reduced ejection fraction.
INTRODUCCIÓN
La insuficiencia cardíaca con fracción de eyección reducida es una entidad de alto impacto socio-sanitario, de creciente prevalencia en los tres niveles de atención de salud, que ha presentado grandes adelantos terapéuticos y diagnósticos en los últimos años, capaces de modificar el pronóstico, evolución y curso natural de la enfermedad, muchos de ellos aún no reflejados a en las guías internacionales o nacionales situación que hacen necesaria su revisión y análisis.1,2
Metodología; Se realizó una revisión narrativa no sistemática mediante una búsqueda bibliohemerográfica acerca de los términos insuficiencia cardiaca crónica, falla cardiaca, tratamiento de la insuficiencia cardiaca, disfunción ventricular, en bases de datos como: Elsevier, Pubmed, SciELO, Medline, Circulation, Journal of the American Medical Association entre otras, durante el período comprendido entre 2010 y 2020 en los idiomas inglés y español, seleccionado en diversas ocasiones estudio previos a esta fechas los cuales debido a su relevancia en el tema hicieron necesario su revisión particularmente en el apartado de estudios clínicos; el método de selección de artículos se basó en una minuciosa lectura de los títulos, resúmenes y textos completos de los documentos que tuvieran entre sus objetivos abordar definición, etiología, epidemiología, características clínicas, métodos diagnósticos y los tratamientos disponibles de la insuficiencia cardiaca crónica, así como de las comorbilidades concomitantes. Adicionalmente se revisaron las referencias bibliográficas de los artículos para identificar los que no se hubieran encontrado en las bases de datos consultadas.
Antecedentes: La insuficiencia cardiaca (IC) es un síndrome clínico caracterizado por síntomas típicos que incluye disnea, ortopnea, usualmente acompañado de signos como ingurgitación yugular, crepitantes pulmonares y edema, originado por una anomalía estructural o funcional del corazón que condiciona un fallo en el aporte del oxígeno necesario para los requerimientos metabólicos de los tejidos periféricos,1 lo que se traduce en un inadecuado gasto cardiaco o la necesidad de presiones intracardiacas de llenado elevadas.2
Epidemiología: Entidad clínica de alto impacto social y sanitario, asociada a altos índices de hospitalización, invalidez y mortalidad, con una prevalencia en países desarrollados del 4.2% de población adulta y llegando a más del 11.8% a partir de los 65 años.3,4 A nivel mundial afecta a 64.3 millones de personas, con una tasa de 1 a 9 casos por cada 1000 personas por año en países europeos.5 Asociándose a una tasa de mortalidad a 5 años del 56%.6
Clasificación. A través del tiempo la IC ha sido clasificada de diferentes formas;7 de acuerdo al tiempo de evolución (aguda o crónica); al lado del corazón afectado (derecha e izquierda o biventricular);8 la fracción de eyección del ventrículo izquierdo obtenida;9 la etiología de la disfunción cardíaca; las manifestaciones clínicas que predominan; el grado de control (clase NYHA I, II,III, IV);10 la clase funcional y los estados evolutivos (estadio A, B, C, D).11
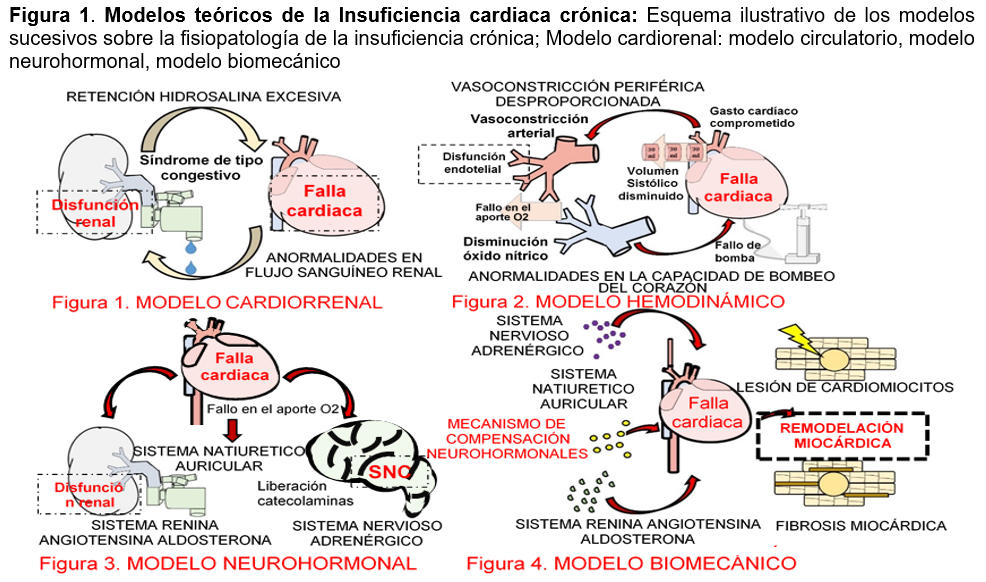
Modelos teóricos de la insuficiencia cardiaca crónica: A lo largo de los años la concepción de este síndrome ha evolucionado, describiéndose diferentes modelos teóricos que tratan de explicar su fisiopatología. Así en 1950, se concebía como un síndrome cardiaco y renal de tipo congestivo por la retención de agua y sal en exceso debido a anormalidades en el flujo sanguíneo renal.12 A partir de 1970, el modelo hemodinámico asoció a la IC con un gasto cardíaco comprometido por anormalidades en la capacidad de bombeo del corazón y una vasoconstricción periférica desproporcionada.13 Fue durante la década de 1990 que se hizo hincapié en el modelo de desregulación neurohormonal provocado por un exceso de activación de mecanismos neurohormonales compensadores que perpetúan el daño cardiaco. Por último, se propuso un modelo biomecánico que consideraba la activación y progresión hormonal de forma crónica, que deja un cambio en la función cardíaca y remodelación de la pared ventricular.13 (ver Figura 1)

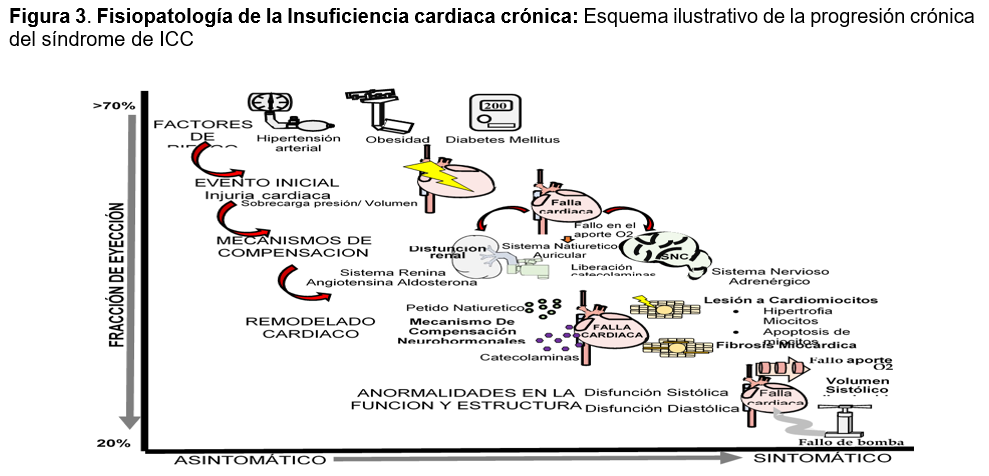
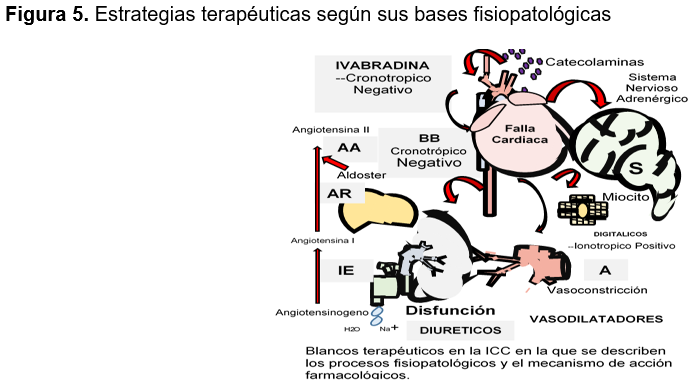
Fisiopatología de la insuficiencia cardiaca crónica: La ICC es un trastorno heterogéneo, crónico y progresivo con un origen no totalmente esclarecido.14 Iniciado después de una agresión al músculo cardíaco súbita o gradual, que independientemente de su intensidad pone en marcha la activación sostenida de pseudomecanismos compensadores en un intento por mantener la integridad circulatoria, provocando a largo plazo efectos nocivos.15,16 (ver Figura 2)
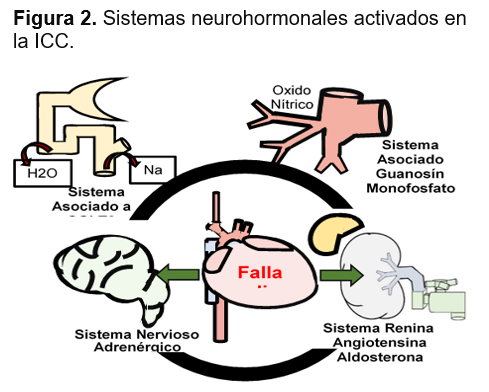
El daño cardiaco inicial produce un bajo gasto, con liberación de catecolaminas y la activación del sistema renina-angiotensina-aldosterona (SRAA) que mejorará la contracción del corazón, el volumen sistólico y la perfusión de órganos vitales a expensas de una vasoconstricción, la retención de agua y sodio e incremento de la carga hemodinámica en busca de mantener un volumen sanguíneo circulante eficaz y compensando temporalmente el problema: esta nueva situación de mayor volemia y por tanto mayor presión de llenado del corazón, es explicada por el mecanismo de Frank Starling en el cual al existir una mayor precarga (presión de llenado del ventrículo) se genera una mayor fuerza de contracción que incrementa el volumen de sangre expulsado del corazón mejorando el gasto cardiaco;7,12,13 en etapas tempranas estos mecanismos son eficaces, sin embargo; el exceso de activación a largo plazo generan la remodelación del músculo cardiaco con lesión de los miocitos (hipertrofia, necrosis y apoptosis), desarrollo de fibrosis, desensibilización adrenérgica y anomalías en el metabolismo energético del miocardio,17 que transforma y deteriora la estructura cardíaca conduciendo eventualmente a un círculo vicioso de empeoramiento.18 (Ver Figura 3)
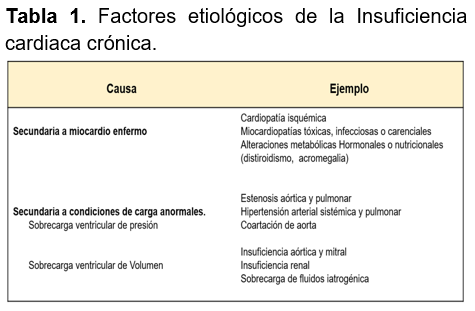
Etiología: Son diversas las enfermedades que pueden conducir a una ICC. Su reconocimiento tiene gran trascendencia.12 De acuerdo a la Sociedad Europea de Cardiología (ESC), se clasifica como ICC por un miocardio enfermo cuando presenta lesiones directas en el músculo cardíaco causantes de alteraciones funcionales y estructurales; en cambio, se denomina ICC secundaria a condiciones de carga anormales de presión o volumen.1,19 (ver Tabla 1)
Manifestaciones clínicas: se originan por alteraciones de la contracción del corazón, el llenado ventricular o como consecuencia de los mecanismos de compensación. Los síntomas y signos se pueden agrupar en alguno de los siguientes síndromes: disminución en la perfusión de los tejidos manifestado por fatiga, somnolencia, oliguria, nicturia, diaforésis, piel pálida, hipotensión y confusión mental: congestión pulmonar caracterizado por disnea, ortopnea o, taquipnea, ruidos crepitantes a la inspiración en ambos campos pulmonares; congestión sistémica manifestada por edema periférico, dolor epigástrico, ingurgitación yugular, hepatomegalia y ascitis.8,20
Diagnóstico; El abordaje diagnostico según la ESC y la Guía Canadiense se origina en la sospecha clínica en base a los antecedentes clínicos, síntomas de presentación o un electrocardiograma sugestivo de la enfermedad. Si uno de los elementos es anormal se debe determinar los Péptido Natriurético (PN) para identificar a los pacientes que requieren ecocardiografía que permita establecer o descartar el diagnóstico.1,9 existen diversos criterios diagnósticos dentro de los más conocidos se encuentran los criterios de Framingham21 y los criterios de la Sociedad Europea de Cardiología (ESC) que incluyen la presencia de síntomas o signos de IC, evidencia de disfunción cardiaca por ecocardiografía o mejoría clínica después del tratamiento farmacológico.1
Estudios clínicos. Además de la historia médica y una exploración física completa, la evaluación clínica de pacientes con IC debe de incluir una serie de pruebas adicionales, entre las que se incluyen variables de laboratorio, electrocardiografía, radiografía torácica y prueba de esfuerzo.22
Biomarcadores (péptido natriurético): Son hormonas neuroendócrinas liberadas por el miocardio en respuesta a sobrecarga de presión, de volumen o daño miocárdico, siendo los tres tipos más estudiados el péptido natriurético atrial (originado en las aurículas generalmente ante estímulos de distención auricular), el péptido natriurético cerebral o tipo B (originado en los ventrículos en respuesta a sobrecarga de presión o volumen ventricular) y el péptido natriurético tipo C (originado en el endotelio vascular en repuesta a cizallamiento). De los cuales el péptido natriurético tipo B y su precursor pre-proBNP son los de mayor relevancia para la práctica clínica.1,7,15,17 Tres son los momentos clave en la IC donde tienen especial valor su cuantificación: durante el diagnóstico, el pronóstico y en la detección preclínica de insuficiencia cardiaca (tamizaje).23,24,25
Electrocardiograma. Se recomienda realizar un electrocardiograma de forma sistemática junto al juicio clínico para descartar el diagnóstico, dado que en los pacientes con IC es poco probable no encontrar hallazgos anormales (Valor Predictivo Negativo de 98%), en consecuencia; orientará sobre la posible etiología y patologías asociadas.1
Radiografía torácica: Permite valorar estructuras torácicas, la vasculatura pulmonar y la silueta cardiaca. Sin embargo; tiene poco uso en el proceso diagnóstico.1
Ecocardiografía. Permite confirmar el diagnóstico y optimizar el tratamiento; cuantifica las alteraciones de la función sistólica y diastólica del ventrículo izquierdo, el grosor de la pared muscular, la función valvular y el grado de hipertensión pulmonar. Aporta, además, una importante información pronostica.1,26
Resonancia magnética cardiaca: técnica de radiodiagnóstico con mayor precisión para medir volumen, masa y la FEVI; es una alternativa de imagen cardiaca para pacientes con estudios ecocardiográficos no diagnósticos o patologías infiltrativas.9
Estudios clínicos adicionales. Son pruebas diagnósticas en la evaluación inicial del paciente con IC de nuevo diagnóstico que se utilizan para determinar si requiere tratamiento específico y detectar causas reversibles (tratables) y comorbilidades que interfieren con ésta. Se recomienda la medición de electrolitos séricos, hemograma sanguíneo, química sanguínea, perfil lipídico, perfil tiroideo, cinética de hierro y pruebas de función hepática.1
Tratamiento no farmacológico. Se basa en el control de los factores de riesgo modificables, mediante cambios en el estilo de vida y autocuidado del propio paciente. Se recomienda la adherencia al tratamiento, cese del tabaquismo, actividad física aeróbica regular, vacunación antineumocócica y antigripal, reducción del peso en caso de sobrepeso u obesidad y evitar el consumo excesivo de alcohol.27,28
Tratamiento farmacológico. El objetivo del tratamiento es de mejorar el estado clínico, la capacidad funcional y la calidad de vida, prevenir hospitalizaciones y reducir la mortalidad, mediante la corrección de variaciones hemodinámicas, la modulación neurohormonal, retraso en el deterioro de la función cardíaca y remodelado de la estructura ventricular, para ello se requerirá el uso de múltiples fármacos los cuales en su conjunto son concebidos por las guías como tratamiento médico optimo, el cual debe ajustarse a las dosis objetivos o bien a las dosis máximas toleradas, realizando su titulación conforme el estado clínico del paciente, buscando lograr dentro de los 3 a 6 meses posteriores al diagnóstico inicial de insuficiencia cardíaca 1,29,30,31 (Ver Figura 4)
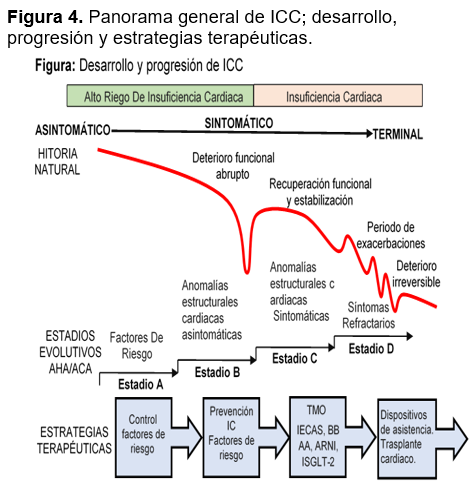
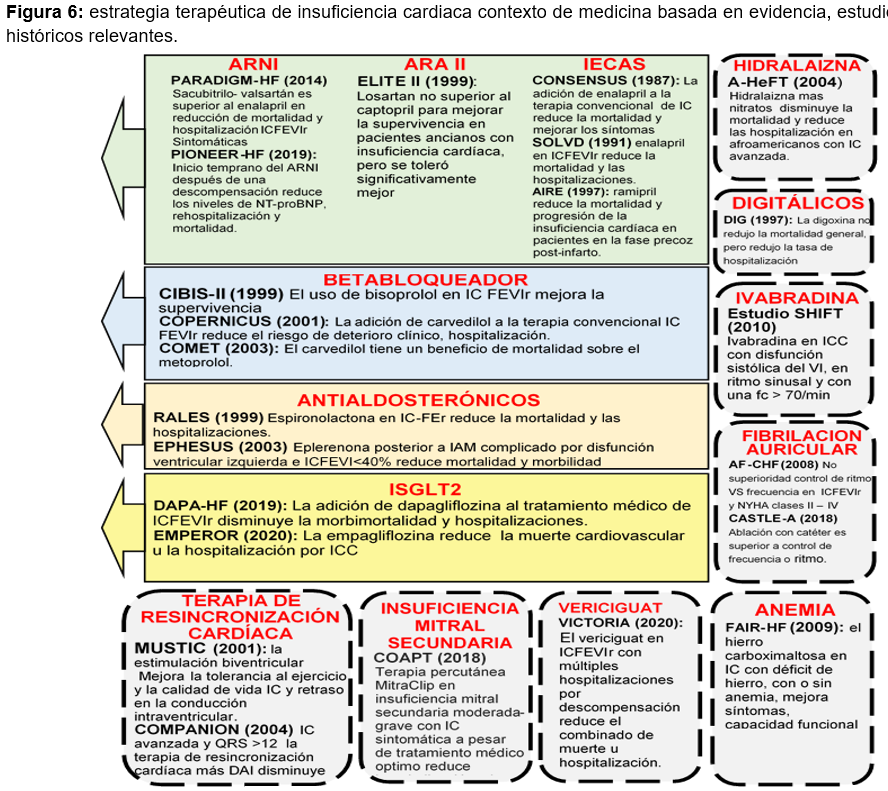
El tratamiento farmacológico tradicional de la IC con FEVI reducida consiste del uso de una triple terapia que incluye la combinación de un inhibidor de la enzima convertidora de angiotensina (IECA) o un antagonista de los receptores de la angiotensina (ARA II) si el paciente es intolerante a los IECA, un bloqueador beta adrenérgico y un inhibidor de la aldosterona sumado a algún diurético en caso de síntomas congestivos.23,32,33 manteniendo monitorización de los síntomas en base a su clase funcional (CF) de acuerdo a la escala propuesta por la New York Heart Association (NYHA). En aquellos pacientes con CF I mantener tratamiento establecido, CF II-IV con Frecuencia cardiaca >70 latidos realizar modificación terapéutica agregando Ivabradina, o realizar cambio de IECA por ARA II o alguna inhibición dual de la neprilisina y del receptor de la angiotensina (ARNI) y CF II-IV con FC <70 latidos realizar modificación terapéutica con el cambio de IECA por ARA II o ARNI.9,34, Sin embargo, estudios recientes enfocan el empleo inicial de cuatros agentes farmacológicos de manera rutinaria: un betabloqueante, antagonistas de la aldosterona, un inhibidor de SGLT2 y un ARNI.31,35 figura 6
Recomendaciones farmacológicas.
a) Betabloqueadores. Fármacos que frenan la hiperactividad crónica del sistema nervioso mediante la reducción de la frecuencia cardiaca y una optimización de la relajación ventricular.36 disminuyendo la morbimortalidad en pacientes con IC de FEVI reducida, dentro de los agentes recomendados se encuentran: carvedilol, bisoprolol, metoprolol y nebivolol y se recomiendan para la disfunción sistólica del ventrículo izquierdo asintomática con historia de infarto del miocardio.1,37
b) Vasodilatadores. Tratamiento que reduce de la vasoconstricción periférica desproporcionada, actuando sobre el componente vascular al producir dilatación venosa (reducción de la precarga) y/o arterial (reducción de la poscarga) provocando un aumentando del gasto cardiaco.38,39,40 Se recomienda añadir al tratamiento óptimo en pacientes de raza afroamericana que presenten IC avanzada con FEVI reducida o en sujetos que no toleren un IECA, ARA II o ARNI. Dentro de los fármacos de este tipo recomendados se encuentran: la hidralazina y el dinitrato de isosorbide.1
c) Inhibidores de la enzima convertidora de angiotensina (IECA). Estos fármacos reducen los mecanismos de hipertrofia y fibrosis miocárdica.36 Se recomienda su uso en caso de disfunción sistólica del ventrículo izquierdo asintomática con o sin historia de infarto del miocardio para prevenir o retrasar la aparición de la IC y prolongar la vida, así como en pacientes sintomáticos con IC con FEVI reducida siempre que no haya contraindicaciones o intolerancia al tratamiento. Dentro de estos fármacos se encuentran el enalapril, el captopril.1
d) Fármacos antagonistas de los receptores de la Angiotensina II. Bloquean el exceso de activación del sistema renina-angiotensina-aldosterona al ligarse al receptor ATI y bloquear los efectos biológicos de la angiotensina II.41 Se recomienda su uso en pacientes con IC crónica intolerante a los IECA. Dentro de estos fármacos se encuentran: el losartan y el telmisartan.1
e) Antagonistas de la aldosterona (AA): Reducen la hipertrofia y la fibrosis del corazón tras el bloqueo de los receptores para la aldosterona.36 Disminuyen la mortalidad y las hospitalizaciones por IC, mejorando la calidad de vida y los parámetros de disfunción diastólica, especialmente con el uso de Espironolactona y Eplerenona.42 Se recomienda su uso en IC con FEVIr sintomática a pesar del tratamiento con un IECA más un bloqueador beta adrenérgico. Además de los casos con IC sintomática posterior a infarto al miocardio con FEVI <40%.1
f) Inhibidores del receptor de la angiotensina y neprilisina (ARNI). Incluye fármacos como sacubitrilo-valsartan que reducen el exceso de estimulación hormonal y la vasoconstricción mediante la degradación de péptidos vasoactivos, la retención de sodio y agua, y la disminución de la hipertrofia miocárdica.43,44 Se recomienda su uso en caso de reemplazo de un IECA en enfermos con IC con FEVI reducida, sintomáticos y que hayan tolerado el uso previo de un IECA o ARA II. 1,45
g) Inhibidores de los canales IF. La Ivabradina es el representante de este tipo de fármacos que produce bradicardia al actuar directamente en el nodo sinusal, aumentando el tiempo de diástole, disminuyendo el consumo miocárdico de oxígeno y mejorando la eficiencia ventricular al retrasar la disfunción endotelial.46,47 Se recomienda en enfermos sintomáticos, con ritmo sinusal y una frecuencia cardiaca >70 latidos por minuto, después de dosis máximas toleradas de un IECA, un bloqueador beta adrenérgico y antagonistas de la aldosterona (AA).1
h) Inhibidores del cotransportador de sodio-glucosa de tipo 2 (SGLT2). El mecanismo de acción farmacológica en la ICC no está bien esclarecido, las teorías más aceptadas postulan que ejerce acciones hemodinámicas diuréticas (reducción de la precarga y poscarga), mejora en el metabolismo energético cardiaco y reducción directa de la masa miocárdica.48 Se recomienda en pacientes con falla cardiaca, fracción de eyección <40% con o sin Diabetes Mellitus. El fármaco recomendado es la Dapaglifozina.45
i) Digitalicos. La Digoxina es el principal fármaco de este grupo. Mejora la sintomatología y la clase funcional de pacientes con IC, ya que tiene la capacidad de aumentar la FEVI, disminuir la frecuencia cardiaca y el flujo sanguíneo, provocando con esto un descenso de las resistencias vasculares y vasodilatación. Se recomienda en casos de IC con FEVI reducida con ritmo sinusal, sintomática y en caso de una IC con FEVI reducida y fibrilación auricular de respuesta ventricular rápida sin otras opciones terapéuticas.1,49
j) Diuréticos. Son fármacos con capacidad de inducir diuresis y natriuresis. Se utilizan para lograr y mantener un volumen sanguíneo adecuado.50,51 El fármaco más representativo de este grupo es la Furosemide que disminuye los signos y síntomas de congestión vascular.1,52
Tratamiento con dispositivos implantables.
Desfibrilador cardioversor implantable (DAI). Diversos estudios han reportado la asociación entre IC con FEVI reducida y muerte súbita, a menudo debido a una arritmia ventricular, situación que ha llevado a la utilización del DAI.53 Se recomienda implantar un DAI en pacientes con disfunción sistólica del ventrículo izquierdo asintomática (FEVI ≤ 30%) de origen isquémico, tras un mínimo de 40 días después de ocurrido en infarto agudo al miocardio o en pacientes con miocardiopatía dilatada asintomática de origen no isquémico (FEVI ≤ 30%) que recibe un tratamiento médico óptimo.1
Terapia de resincronización cardíaca (TRC). Estrategia terapéutica utilizada en la IC con FEVI reducida que corrige los trastornos de la conducción intra-ventricular, restableciendo la sincronía ventricular y auriculo-ventricular mejorando el remodelado reverso y la función diastólica, lo que disminuye los síntomas y la mortalidad.54 Se recomienda en casos de una IC sintomática, con FEVI <35%, ritmo sinusal y bloqueo completo de rama Izquierda con duración del QRS 130 ms a pesar del tratamiento médico óptimo.1,55
Comorbilidades concomitantes con ICC: La ICC podría ser concebida como una condición sistémica que afecta y se ve afectada por varios órganos coexistiendo con otras comorbilidades (diabetes, insuficiencia renal crónica, enfermedades pulmonares, obesidad, apnea del sueño, hipertensión y fibrilación auricular), dando como resultado una relación bidireccional entre los síntomas cardiovasculares y de otros sistemas.56,57
Fibrilación auricular en la insuficiencia cardiaca crónica; coexisten en más del 50% de los casos, asociándose con un aumento del riesgo cardiovascular, deterioro de la función ventricular y deterioro clínico, considerándose por ello un ciclo electromecánico vicioso.58,59 Actualmente no existe un consenso sobre la mejor forma de tratar la fibrilación auricular con ICC. Sin embargo, se recomienda lo siguiente: El control de la frecuencia cardiaca y del ritmo se consideran igualmente efectivos; se recomienda control del ritmo cardiaco agresivo solo en pacientes altamente sintomáticos a pesar del control de la frecuencia cardiaca; se recomienda el uso de la Amiodarona y la Dofetilida para el control del ritmo sinusal; se recomienda ablación con catéter como terapia de segunda línea a menos que sea la preferencia inicial del paciente; es recomendable evaluar el riesgo tromboembólico en todos los casos.60,61,62
La anemia en la ICC: se asocia al deterioro clínico, reingresos hospitalarios y disminución de la supervivencia, desencadena cambios en la estructura y función cardíaca, provoca activación del sistema neurohormonal y disminución de la clase funcional; su desarrollo está relacionado a la hipoperfusión sistémica, la reducción del filtrado glomerular, a alteraciones en la producción de eritropoyetina y hemodilución; siendo su principal etiología la deficiencia de hierro.63,64 Para lo cual se recomienda, el uso de hierro intravenoso (carboximaltosa férrica) para pacientes en clase funcional NYHA II-III, con ferritina menor a 100 ng/mL y Ferritina en el rango de 101 a 300 ng/mL si la saturación de transferrina es menor a 20.1
Diabetes Mellitus en la ICC; presenta un vínculo fisiopatológico complejo y multifactorial, implicándose además de la afección coronaria, un daño miocárdico por glucotoxicidad, disfunción microvascular, alteraciones funcionales en el miocito y una disposición alterada del colágeno, condicionante de cambios estructurales y funcionales.65,66 En este contexto fisiopatológico se han diseñado terapias como los inhibidores del cotransportador de sodio y glucosa de tipo 2 (SGLT2) con un efecto glucosúrico que trae consigo natriuresis, pérdida de peso, reducción de la presión arterial, aumento del hematocrito, efectos beneficiosos en la insuficiencia cardiaca.(67) Se ha recomendado lo siguiente para el uso de los inhibidores del cotransportador de sodio y glucosa de tipo 2 (SGLT2):45 utilizar SGLT2 en pacientes con DM y enfermedad cardiovascular, para reducir el riesgo de hospitalizaciones por IC y muerte; utilizar Dapaglifozina en mayores de 50 años, diabéticos con factores de riesgo adicionales para IC y reducir el riesgo de hospitalizaciones; utilizar Canaglifozina en mayores de 30 años, diabéticos con macro albuminuria para reducir hospitalizaciones por IC y progresión de la enfermedad renal; utilizar Dapaglifozina con IC y FEVI <40% con o sin diabetes.1
Insuficiencia renal crónica asociada a la ICC; existe una interacción bidireccional entre el corazón y la disfunción renal.68,69 que ha llevado el desarrollo de clasificaciones como el síndrome cardio-renal, en un esfuerzo por unificar y comprender la asociación entre los dos órganos.70 Existe escasa evidencia del tratamiento en pacientes con ICC y disfunción renal crónica en estadios avanzados; consecuencia de la exclusión de pacientes renales en estadios terminales de ensayos terapéuticos.71,72 Para lo cual, se recomienda la dosificación farmacológica en base a la filtración glomerular, individualizar el tratamiento con IECA, ARAII o AA, monitorización electrolítica y de la función renal, considerando restricciones de la terapia renal de reemplazo acorde al valor de la FEVI.58,71,73
Conclusiones:
La insuficiencia cardiaca con fracciones de eyección reducida es una entidad de alto impacto social y sanitario que ha presentado grandes avances diagnósticos y terapéuticos en las últimas décadas, producto de un mejor entendimiento de los mecanismos fisiopatológicos que intervienen en el desarrollo de esta enfermedad; llevando con ello al empleo de tratamientos más eficaces enfocados en la modulación farmacológica de la actividad neurohormonal y la utilización de dispositivos implantables, reducido su mortalidad y mejorando la calidad de vida; así mismo, se han establecido estrategias preventivas y algoritmos diagnósticos más específicos a partir del empleo de biomarcadores y estudios ecocardiográficos. No obstante, aún existen múltiples lagunas en el conocimiento de esta patología que requieren de seguir investigándose.
Agradecimientos; Los autores agradecen al Dr. Padilla médico especialista en cardiología y al Dr. Félix médico residente de cardiología en el Centro Médico Nacional del Noroeste Hospital de Especialidades No. 2 “Luis Donaldo Colosio Murrieta”, Ciudad Obregón, Sonora, México.
REFERENCIAS